一、 阿联酋MOHAP监管信息简介
1. 监管局及简介

阿联酋卫生和预防部(Ministry of Health and Prevention,MOHAP)负责制定医疗器械监管的政策、法规和标准,同时也承担医疗器械的市场准入审批、质量监督等众多职责。

此外,迪拜卫生局(Dubai Health Authority,DHA)和阿布扎比卫生局(Abu Dhabi Health Authority,HAAD)等地方卫生局也在各自辖区内发挥重要的监管作用,这些机构之间相互协作确保法规的有效实施。
2. 监管法规
Medical Device Registration Guideline 2019
2019 年第 8 号法律是医疗器械监管的重要法律依据,适用于药品、医疗器械以及与健康相关的消费品
欧洲医疗器械指令(Medical Device Regulation,MDR)
3. 医疗器械和IVD产品风险等级分类
阿联酋MOHAP(阿联酋国家卫生事务部)对医疗器械的分类遵循欧洲医疗器械指令(Medical Device Regulation,MDR)和欧洲医疗器械调和标准(Medical Device Harmon),按照风险等级从低到高医疗器械分为:,Ⅰ、Ⅱ、Ⅲ、Ⅳ类四个类别类。体外诊断器械(IVD)分为 A、B、C、D 类。

4. 准入必要条件
①产品注册申请表需由公司填写、签字并盖章
②工厂有效注册证复印件
③由阿联酋大使馆认证的原产国主管部门签发的自由销售/注册证书
④公司与经销商/代表签署的授权副本
⑤质量合格证书/营销授权证书,例如 EC、510 (K)、PMA,根据设备的分类,即 I、II、III、IV 类
⑥上市后监测要求。
⑦其他国家的产品注册证复印件。
⑧产品信息,包括描述、配方、类型、尺寸、型号、配件、用途、副作用、矛盾、警告、注意事项、使用指南、包装封面照片、手册和用户手册。
⑨提供实验室要求和分析,以及某些医疗设备的定价。
⑩提供三个样品(根据设备类型)、分析证书(根据设备类型)、内外封面和手册。
⑪公司确认设备符合《医疗设备手册》(CE 符合性声明)的规格。
⑫安全性和有效性数据(针对 III、IV 类产品)。
⑬特殊要求:动物产品制造设备的合格证书。
5. 语言
阿拉伯语
二、 注册流程、周期&官费
1. 注册流程图
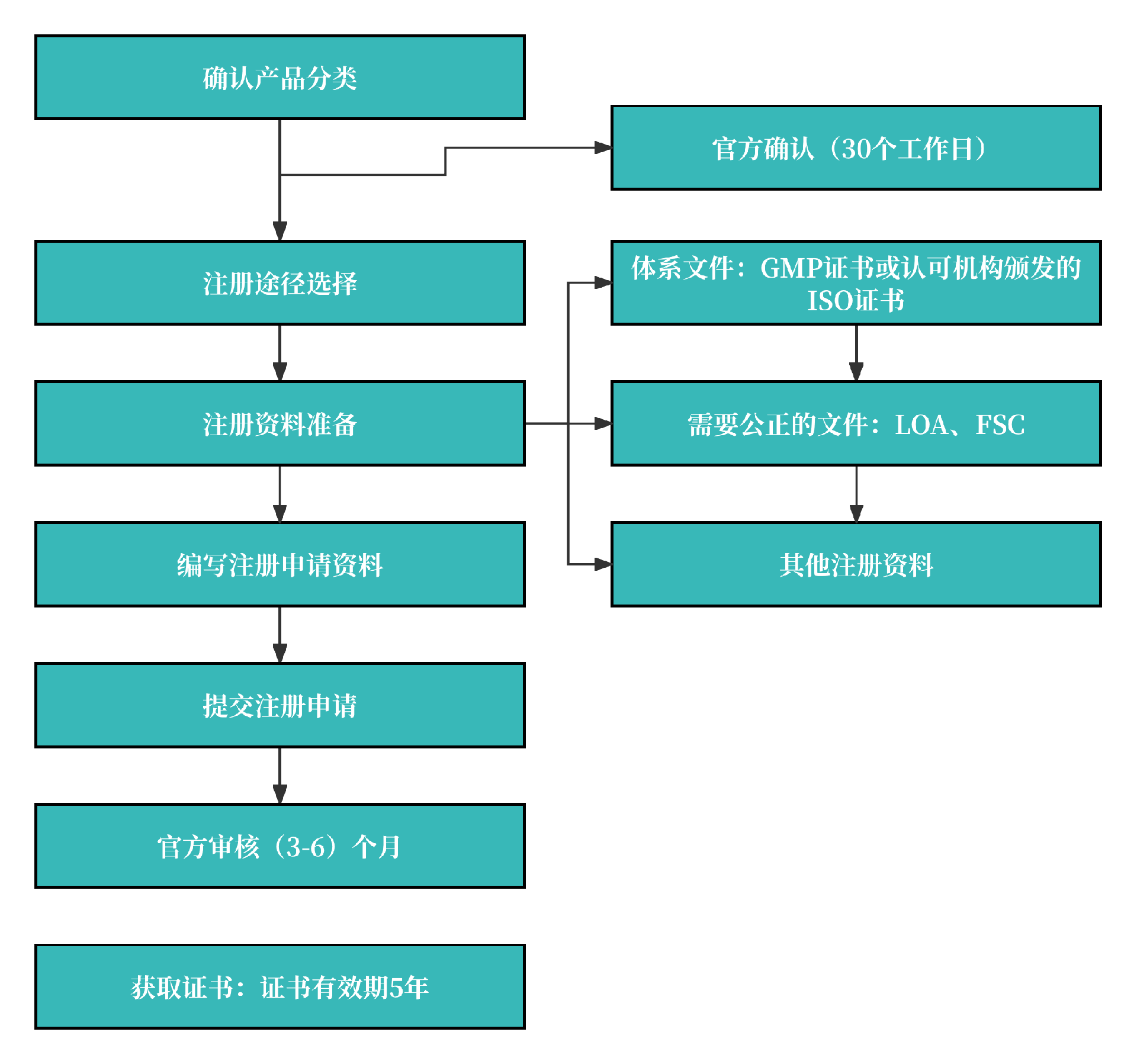
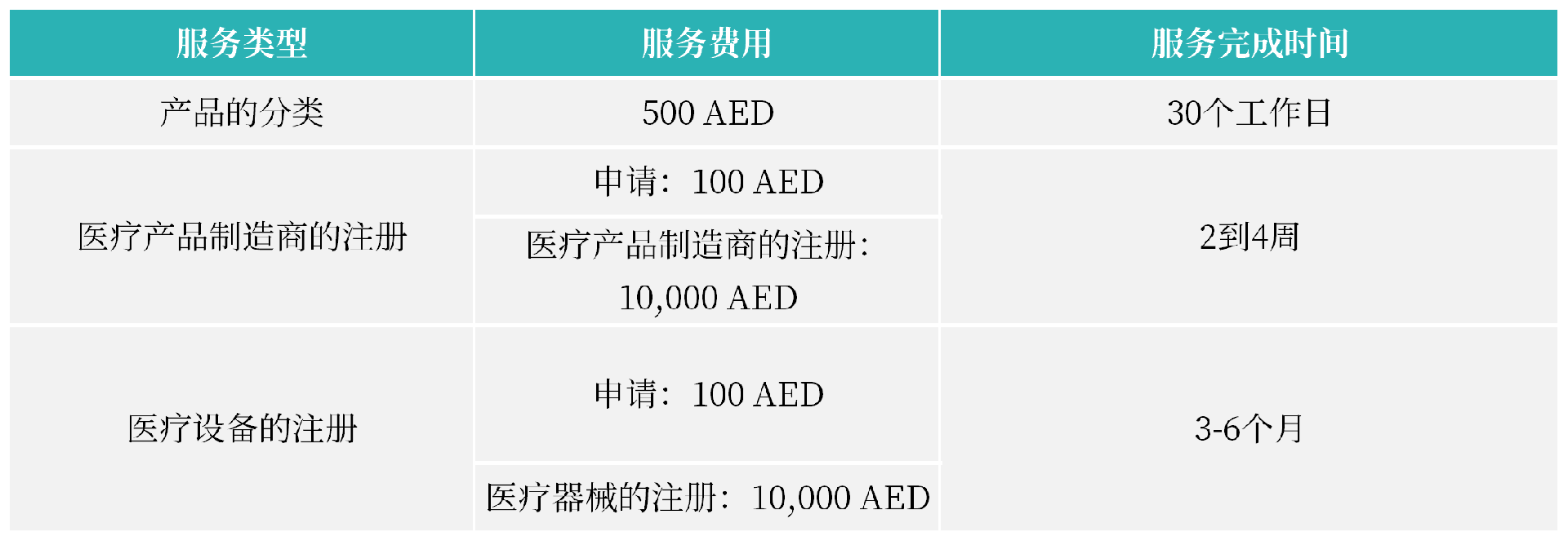
2. 注册周期及官费
三、 FAQ
Q:已经有哪些国家的注册证书可以加快阿联酋注册?
A:对于已经获得欧盟、美国、澳大利亚、加拿大或日本的医疗器械,可以简化注册流程。
Q:阿联酋注册证书有效期多久?
A:医疗器械的注册有效期为五年,应在器械注册期满前至少 90 天进行注册续展,需要建立PMS体系,续期服务完成需要15个工作日,申请费用为100AED,续期服务费用为2500AED。
Q:标签和说明书有哪些要求?
A:标签和说明书应使用阿拉伯语或英语,并确保信息的准确性和易读性。对于阿拉伯用户,应提供阿拉伯语翻译,以确保用户能够正确理解产品信息和使用方法。标签和说明书应明确标注医疗器械的潜在风险、禁忌症、使用方法、维护保养等警示和注意事项,高风险医疗器械需提供更详细的警示信息。
Q:阿联酋注册需要当地测试吗?
A:对于某些高风险或特殊类型的医疗器械,MOHAP 可能会要求进行样品测试。测试将在MOHAP指定的实验室进行,以验证产品的性能、安全性和有效性。
Q:阿联酋注册之前一定要监管局进行风险等级分类吗?
A:是的。监管局对风险等级分类鉴定官方费用为500AED,时间为30个工作日。

