一、 菲律宾PFDA监管信息简介
1. 监管局及简介


菲律宾食品和药物管理局PFDA(Philippine Food and Drug Administration,PFDA)负责批准和监督医疗器械的市场准入、销售以及后续的合规性监管等工作。
2. 监管法规
[REPUBLIC ACT NO. 9711] <第9711 号共和国法>
[The Rules and Regulations
Implementing Republic Act No. c)71I-'the Food and Drug [Administration Act of 2009] <2009年食品和药物管理法的监管>
3. 医疗器械和IVD产品风险等级分类
①菲律宾原产品分类根据东盟医疗器械指令AMDD附录3进行了统一,将治疗或医疗用途的仪器、机器、体外试剂、软件和类似或相关物品等医疗器械分为 A、B、C 和 D 四个等级,从低风险到高风险分类。
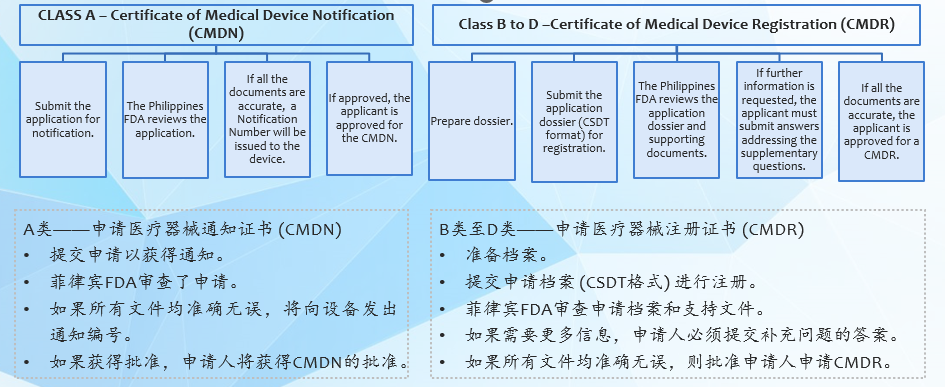
②医疗器械通知证书(CMDN)适用于A类医疗器械。
③医疗器械注册证书(CMDR)适用于B、C和D类医疗器械。
④医疗器械上市证书(CMDL)——指为用于研究、临床试验、展览、捐赠等而非用于销售的医疗器械颁发的授权。
在菲律宾,含有药物的设备不被视为医疗设备。
IVD(体外诊断)与其他医疗器械分开分类,按风险由低到高,也分为 A 级、B 类、C 类、D 类。体外诊断 (IVD) 医疗器械分为可注册和不可注册。目前,只有8种IVD医疗器械被认为是可注册的:
①HIV(抗体和/或抗原)、HBV(HBsAg和其他标志物)、HCV(抗体和或抗原)和梅毒试剂盒
②替代药物的单一或组合药物筛选试剂盒/试剂
③抗A、抗B、抗D、抗AB血型血清
④抗人球蛋白试剂
⑤酶、LISS和白蛋白等增效剂
⑥交叉配型和血型的柱凝集试验
⑦妊娠测试试剂盒/试剂
⑧钩端螺旋体病检测试剂盒/试剂
⑨血液采集管
4. 准入必要条件
①MD和IVD都需要 ISO 13485 或美国 FDA 或日本 PMDA 的QMS审核报告,以证明合法或实际制造设施的质量体系。
②授权书(授权书副本应附有合法制造商或产品所有者证明授权真实无误的公证声明原件)。
③政府颁发的证明制造商在人员和设施的能力和可靠性方面的地位的证书、质量体系批准证书或 ISO 13485 合规证书(证书副本应附有原件来自合法制造商或产品所有者的公证声明副本,证明该证书是真实和正确的)。
④由原产国监管机构或认可的公告机构颁发的产品注册证书或任何证明设备安全性和有效性的等效文件(证书副本应附有合法制造商或产品所有者证明证书真实无误的公证声明原件)。
⑤除了上述文件外,还需要设备描述、符合性证书、符合性声明、保质期声明和清晰、完整、彩色的标签图片等。
⑥对于 IVD 产品,不同风险等级还需按照相应要求提交技术文档。
5. 注册语言
英语
6. 菲律宾LTO
LTO即经营许可证,是菲律宾当地医疗器械进口商、分销商、贸易商和制造商必须获得的资质。它用于确保企业合法经营医疗器械,规范市场秩序,保障产品质量和安全。获取 LTO 需满足企业注册合规、人员资质培训、质量管理体系、设施设备等条件,并经过申请准备、提交、审核检查、审批发证等流程。
二、 注册流程、周期&官费
1. 注册流程图
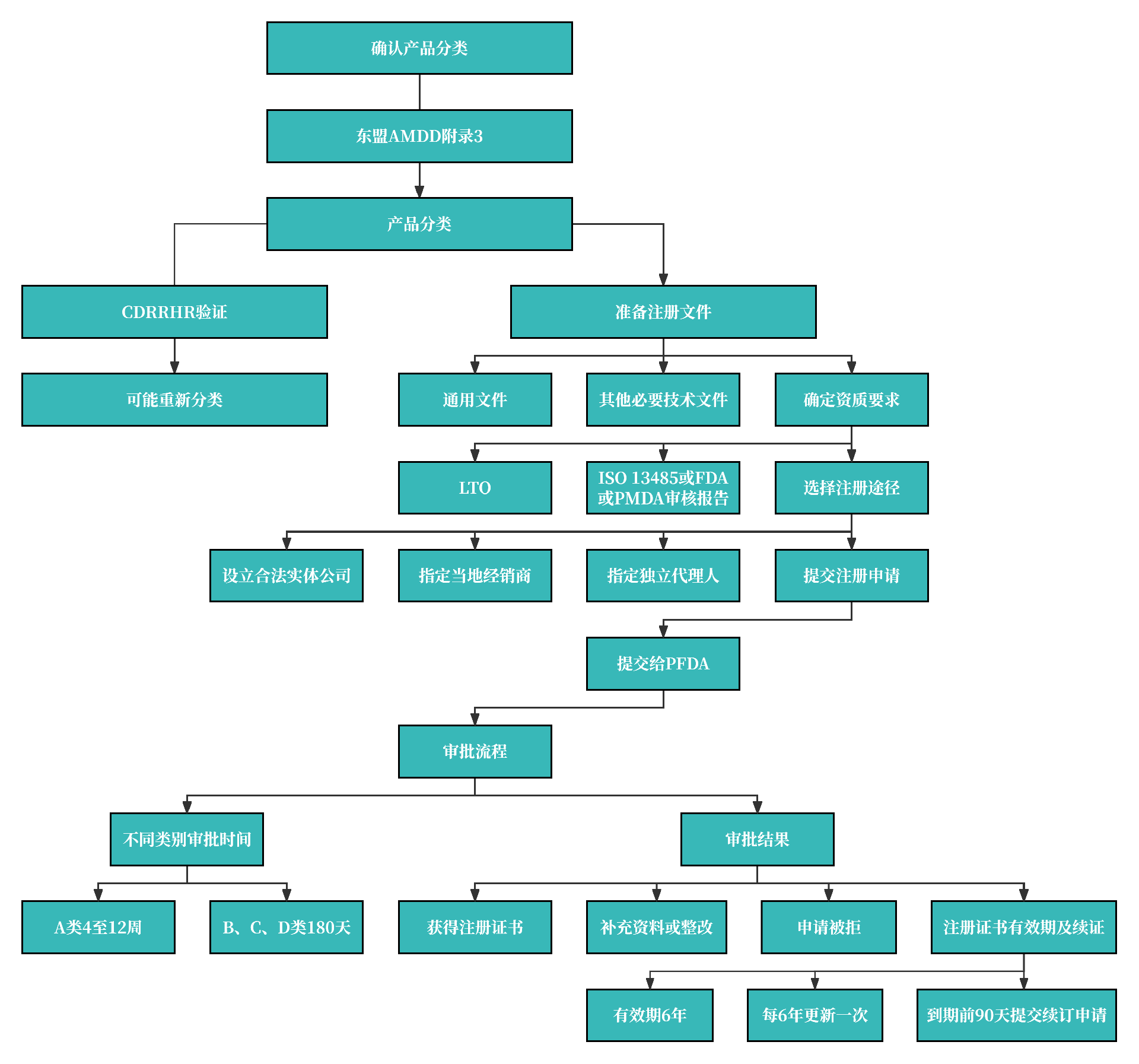
2. 注册路径
3. 注册周期及官费
申请官费:
A 类医疗器械的申请官费为 81810 菲律宾比索,B 类医疗器械的申请官费为 109080 菲律宾比索,C 类医疗器械的申请官费为 112110 菲律宾比索, D 类医疗器械的申请官费为 118170 菲律宾比索。
注册周期:
A类 4-12周
BC D类 180天
三、 FAQ
Q:什么是经营许可证(LTO)?
A:LTO 是 FDA 向企业颁发的授权,用于授予开展贸易或开展商业活动的许可,例如医疗器械的制造、进口、出口、销售、要约销售、分销或转让。
Q:医疗器械注册证书有效期多久?需要提前多久延续证书呢?
A:5年,可以 到期前 90 天提交续签申请。
Q:医疗器械上市申请需要哪些材料?
A:需公证申请表、致相关机构的说明用途及责任的公证信、原产国监管机构出具的产品安全有效性证明文件,适用时需提供 SEC 或 DTI 注册副本。
Q:医疗器械在菲律宾允许有多个持证人吗?
A:获得CMDN/CMDR/CPR或产品批准许可证的公司也称为产品许可证持有人。如果制造商/供应商与分销商(进口商/出口商/批发商)之间的协议是非排他性的,则允许在菲律宾使用不同分销商许可证持有人的医疗器械进行多次注册。
Q:证书允许转让吗?
A:允许。
Q:菲律宾产品注册证书有效期是多久?
A:CMDN和CMDR证书的有效期为六年,此后可以续期,CMDR和CMDN到期前九十日内,应提交续期证书的注册或通知申请,在CMDR到期后一百二十日后提交的CMDR续期申请将不予受理,并应视为初始申请。
Q:证书续期审批周期是多久?
A:续期申请会在提交申请后三十天内进行评估。所有不符合技术要求的申请将会通过信函通知,并在三十天内给予一次纠正缺陷的机会。

