一、 新加坡监管部门
1. 新加坡HSA

新加坡卫生科学局HSA(Health Science Authority) 负责监管新加坡医疗器械的进口、制造、出口和供应,以保障公众健康和安全。
医疗器械在获取流通权限之前需要先在在线通过MEDICS(Medical Device Information and Communication System)提交产品文件,产品列名或注册后才能合法销售。
2. 监管法规
新加坡作为一个卫生高度监管的国家,对于整个框架体系的要求是比较严格,整体要求和欧美比较贴近。
Health Products Act 2007
Health Products (Medical Devices) Regulations 2010
ASEAN Medical Devices Directive (AMDD)
3. 风险等级分类
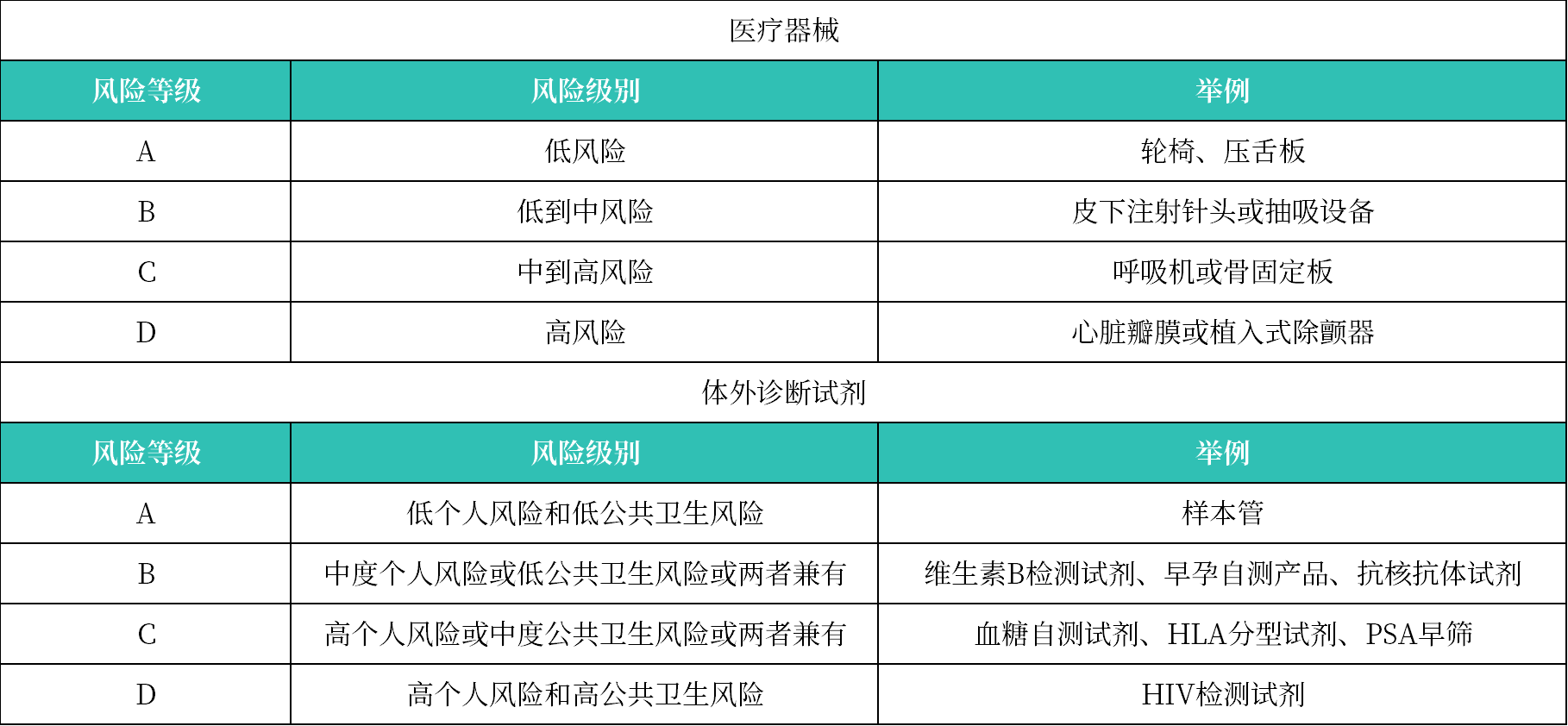
确定产品风险等级分类的方法如下:
方法一:查阅GN-13-R2.1 Guidance on the Risk Classification of General Medical Devices和GN-14-R2 Guidance on the Risk Classification of In Vitro Diagnostic Medical Devices的分类规则,依据分类规则判断产品风险等级。
方法二:利用官网上的风险等级决策小工具进行判断HSA | Medical device risk classification toolh
方法三:利用新加坡医疗器械数据库Public Enquiry - Singapore Medical Device Register (SMDR)查询同类产品的风险等级。
4. 注册依据
医疗器械和IVD产品都需要提供有效的ISO 13485证书才能提交HSA注册。
如果能提供参考国注册证书则可以加快注册进度,目前HSA认可的参考国注册证书有:
— 澳洲TGA证书
— CE证书
— 加拿大MDL证书
— 日本MHLW证书
— 美国FDA clearance/De Novo/PMA
新加坡允许将设备分组并命名为 Single、Family、System、Test kit 或 Group。可利用官方的决策小工具HSA | Medical device grouping tool
产品注册资料必须按照东盟共同提交档案模板 (CSDT) 准备
在新加坡,申请必须通过医疗器械信息和通信系统 (MEDICS) 在线提交。在提交之前,公司必须申请 CRIS(客户注册和识别服务) 帐户并注册为 CRIS 管理员才能访问MEDICS
申请企业必须是本地实体公司,否则,需授权当地实体公司作为授权代表,也是注册人
指定的进口商和批发商必须拥有符合良好分销规范医疗器械许可证 GDPMDS 或 ISO 13485 的经销商许可证
GDPMDS 认证应从新加坡认可委员会认可的认证机构获得(可参考Wiselink SG公司GDPMDS证书模板)
5. 注册语言
英语
二、 注册流程|路径|费用|周期
1. 注册流程

非无菌A类医疗器械可以免除注册,但是需要在经销商执照申请期间填写医疗器械信息和通信系统(MEDICS)中的A类豁免清单并告知HSA。
无菌A类医疗器械 (含体外诊断器械) 仍需进行注册。
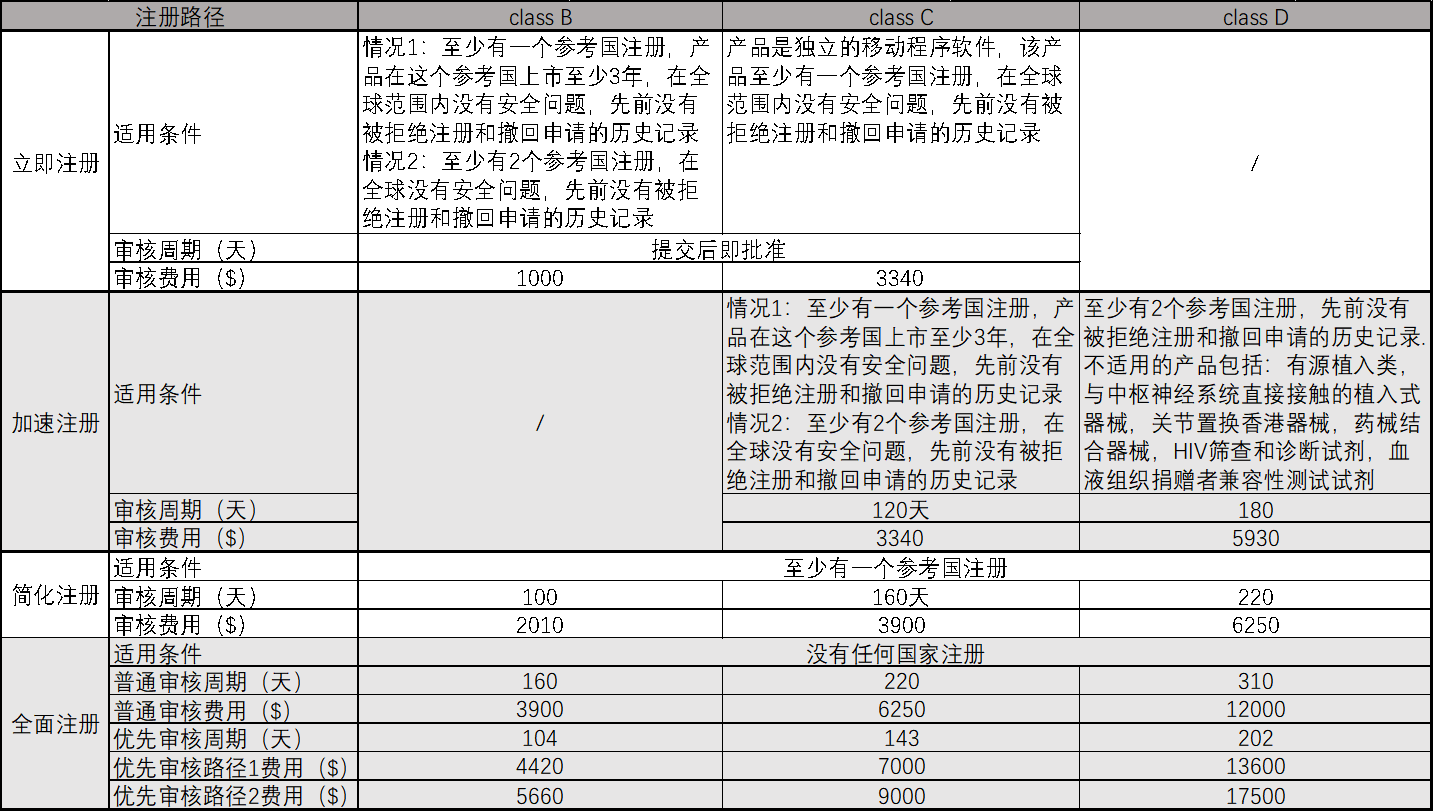
2. 注册路径
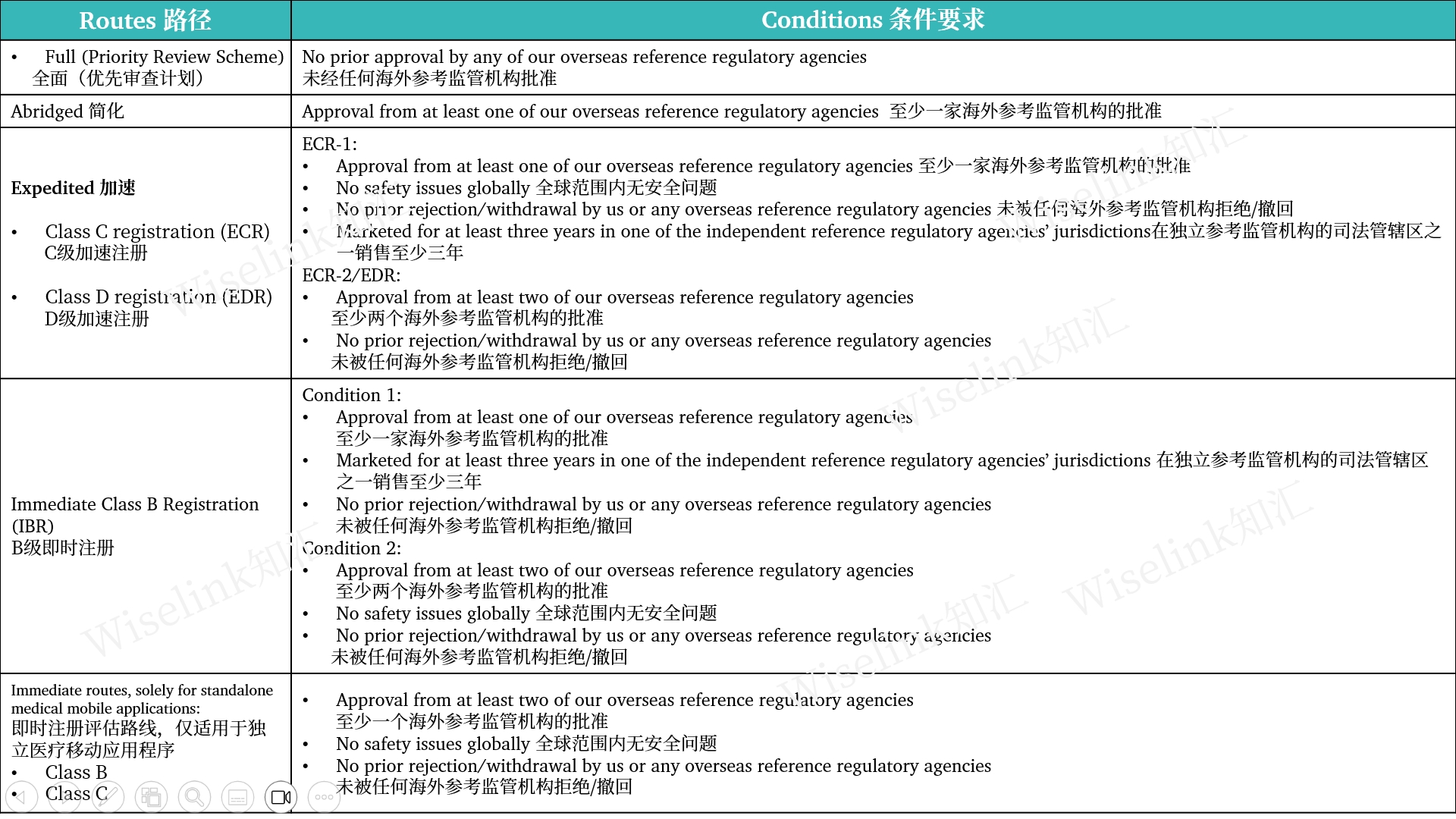
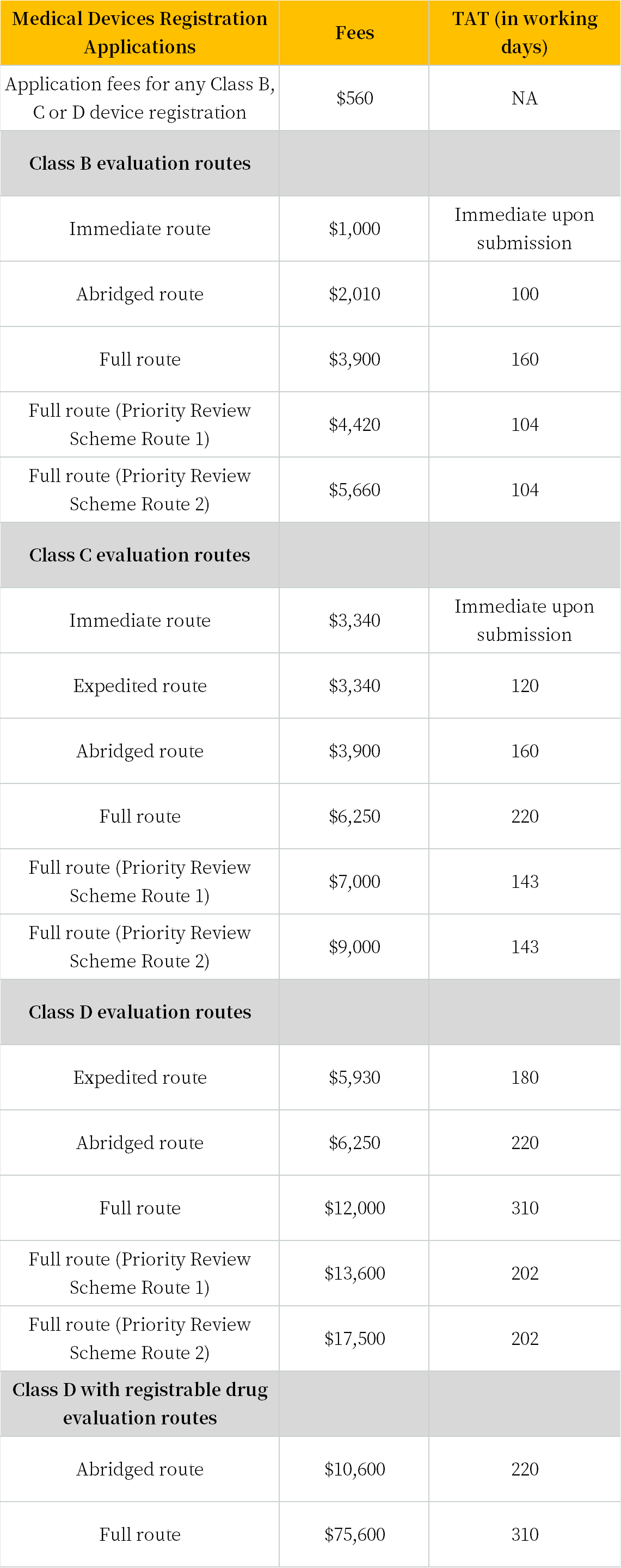
3. 注册官费|周期
HSA | Fees and turnaround time for medical devices
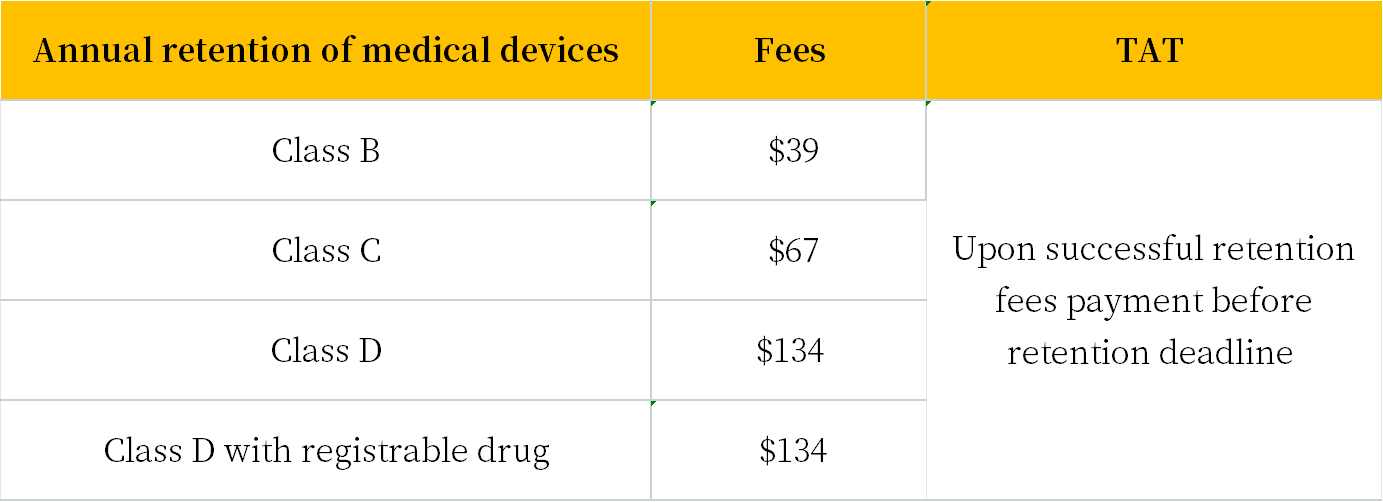
Annual retention in the Singapore Medical Device Register (SMDR)
Change of registrant
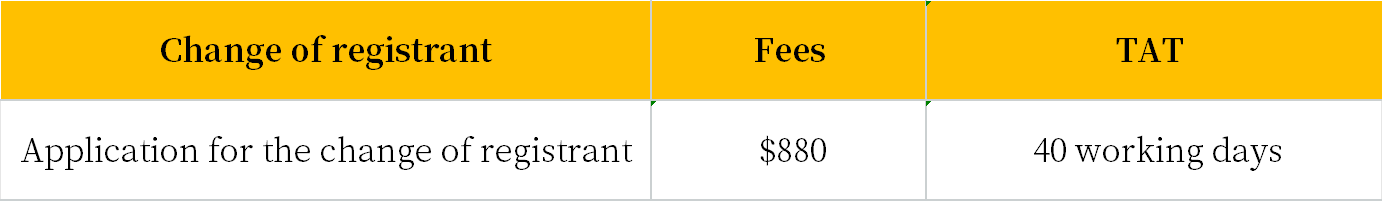
汇总如下:
4. 当地代表(许可证持有人)要求
①注册人不需要HSA的许可证,但必须在医疗器械信息和通信系统 (MEDICS) Medical Device Information Communication System中注册。
②所有的医疗器械必须由注册人提交,注册人进行提交并负责上市后的一些活动。
③注册人还需要监管控制制造商在新加坡的授权进口名单,如果注册人是独立第三方,需要对分销商或者进口商进行授权才能完成整个闭环的工作。
④对于同一个设备可以由多个注册人进行注册。如果企业和前一位注册人关系破裂,除非之前的注册人愿意转移证书,否则必须重新进行注册。
⑤许可进口商需要 ISO 13485 和/或良好分销规范医疗器械 – 新加坡 (GDPMD-S) 许可证,并且必须在HSA 注册。
三、 FAQ
Q:医疗器械产品完成注册后可以进行注册变更吗?
A:可以。如果医疗器械产品有重大变更,则需要向HSA提交变更申请。
Q:医疗器械进行注册需要QMS证书吗?
A:医疗器械在注册时HSA认可特定机构颁发的ISO 13485证书, Wiselink根据项目经验建议选择IAF成员组织颁发的ISO13485证书。
Q:新加坡医疗器械注册过程中对进口商有什么要求?
A:产品注册过程中不需要提交进口商信息,但在产品销售之前需要提供进口商信息并由新加坡持证人上传至系统。
Q:没有原产国的注册证可以做新加坡注册吗?
A:可以。
Q:新加坡注册证书可以转让注册人吗?
A:可以。Health Products Act 2007规定了与有效上市相关的注册人转让。在指南在GN-24 Guidance on the Change of Registrant中提供注册人变更内容。
四、 证书模板

五、 Wiselink Group新加坡子公司Wiselink SG
WISELINK MEDICAL(SINGAPORE)PET.LTD.是Wiselink Group的全资新加坡子公司,拥有新加坡医疗器械、化妆品的进口、经销资质,可以作为制造商在新加坡的当地代表,也可提供新加坡公司注册、申请经营资质、技术负责人、GDPMDS体系辅导、会计审计、办理外国人工作签证等服务。


