- 澳洲TGA认证
- 泰国TFDA认证
- 印尼BPOM认证
- 新加坡HSA认证
- 马来西亚MDA认证
- 南非SAHPRA认证
- 欧盟CE认证
- 台湾TFDA认证
- 日本PMDA认证
- 越南MOH认证
- 印度CDSCO认证
- 印尼MOH认证
- 菲律宾PFDA认证
- 美国FDA认证
- 英国UKCA认证
- 巴西ANVISA认证
- 加拿大HC认证
- 澳大利亚化妆品认证
- 沙特SFDA认证
- 阿联酋MOHAP认证
- 墨西哥COFEPRIS认证
- 俄罗斯RZN认证
- 巴基斯坦DRAP认证
- 厄瓜多尔ARCSA认证
- 新西兰MEDSAFE认证
- 秘鲁DIGEMID认证
- 埃塞俄比亚EFDA认证
- 塞尔维亚ALIMS认证
- 埃及EDA认证
- 孟加拉DGDA认证
- 肯尼亚PPB认证
- 乌兹别克斯坦认证
- 尼日利亚NAFDAC认证
- 中国NMPA认证
- 中国香港MDACS认证
- 中国澳门ISAF认证
- 土耳其TITCK认证
- 韩国MFDS认证
- 哥伦比亚INVIMA认证
- 澳洲海牙Apostille认证
- ISO质量体系辅导
- MDSAP认证
- 代理人服务
- 自由销售证书FSC
巴基斯坦DRAP认证
当前位置: 首页>>全球合规认证>>巴基斯坦DRAP认证巴基斯坦医疗器械DRAP认证
分类
| 巴基斯坦医疗器械分类 | ||
| 国际分类 | 例子 | 风险等级 |
A级 | 简单的伤口敷料棉绒,无针注射器,尿液收集瓶,压缩袜,检查手套 | 低 |
B级 | 非药浸纱布敷料,输血管,导尿管 | 中低 |
C级 | 慢性溃疡伤口敷料,严重烧伤敷料,血袋 | 中高 |
| D级 | 血管成形术球囊导管和相关导线,专用的一次性心血管外科手术器械,乳房植入物 | 高 |
上市前审批流程
1
合格评定程序: 准备合格声明(DoC) 并建立质量管理体系 (OMS),包括符合ISO 13485的证明
2
准备通用的提交档案模板(CSDT),其中包括医疗器械的分类和描述,临床前研究信息,临床证据,有关器械是新颖还是危险的信息,并证明符合性。CSDT应以英语书写。
3
然医疗设备委员会 (MDB) 将审查档案并批准注册
巴基斯坦医疗器械认证流程

| Wiselink答疑 | |
有效期 | 5年 |
费用 | 注册费用: 1440至3634美元,具体取决于设备类型和 |
本地测试 | 不需要 |
临床研究 | 需要 |
| 上市后监视 | 制造商必须建立,维护和实施售后监控系统。 |
Wiselink-全球布局
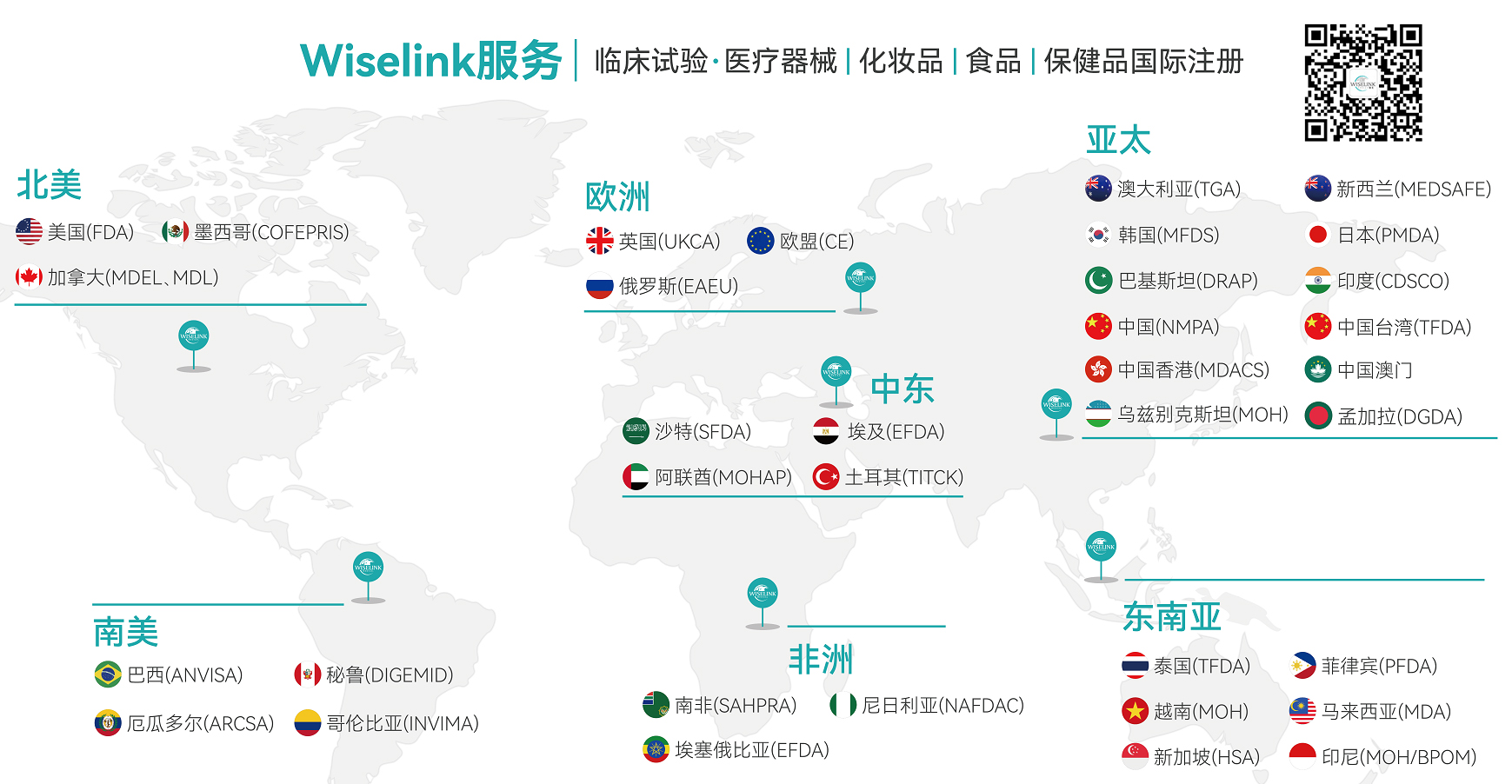
知汇供应链服务(深圳)有限公司 WiselinkSupply Chain Services (Shenzhen) Ltd,简称Wiselink CN隶属于澳大利亚Wiselink集团,是深圳大兴集团的官方合作企业,拥有包括原澳大利亚药品监督管理局局长Dr.Derrick Beech为首席顾问的国际专业团队,秉承源于澳洲、扎根中国、服务世界的精神,信守专业、客观、真诚的核心价值观,致力于为体外诊断(IVD)、医疗器械(MD)、保健品和化妆品制造商提供海外临床试验和全球合规认证服务。
集团总部
Wiselink Group
Level 25 100 Mount Street, North Sydney, NSW Australia2060
欧洲分公司
Wiselink Medical (lreland) Limited
Unit 1/4/7Block 1 Northwood Court, Northwood Crescent,Dublin 9. D09 E438, lreland
美国分公司
Wiselink Medical Inc
666 Old Country Rd, Suite 201, Garden City, NY 11530
泰国分公司
Wiselink Medical (Thailand) Company Limited
No. 1 Vasu Building 1, Room No. P01, 1st Floor, Soi Sukhumvit 25, Sukhumvit Road, Klongtoey Nuea Subdistrict, Wattana District Bangkok 10110, Thailand
日本分公司
株式会社Wiselink Japan
地址:東京都千代田区神田須田町一丁目2番地7淡路町駅前ビル3階
新加坡分公司
Wiselink Medical (Singapore) Pte.Ltd.
(SG) 08-07,175A, Bulington Square,Bencoolen Street 189650 Singapore
中国分公司
知汇供应链服务(深圳)有限公司
地址:深圳市宝安区新安街道稻兴环球科创中心A座1812室
官网:Http://www.wiselinkchina.com

