一、 秘鲁DIGEMID监管信息简介
1. 监管局及简介

秘鲁的医疗器械监管部门是药品和药物管理局Dirección General de Medicamentos,Insumos y Drogas(DIGEMID),主要负责医疗器械的注册监督和管理、文件审核、技术评估、安全性测试以及质量管理体系审核、医疗器械销售许可证的审批等。
2. 监管法规
Ley N° 29459 及其修正案 Decreto Supremo N° 020-2024-SA
Decreto Supremo N° 016-2011-SA 及其修正案 Decreto Supremo N° 010-2023-SA
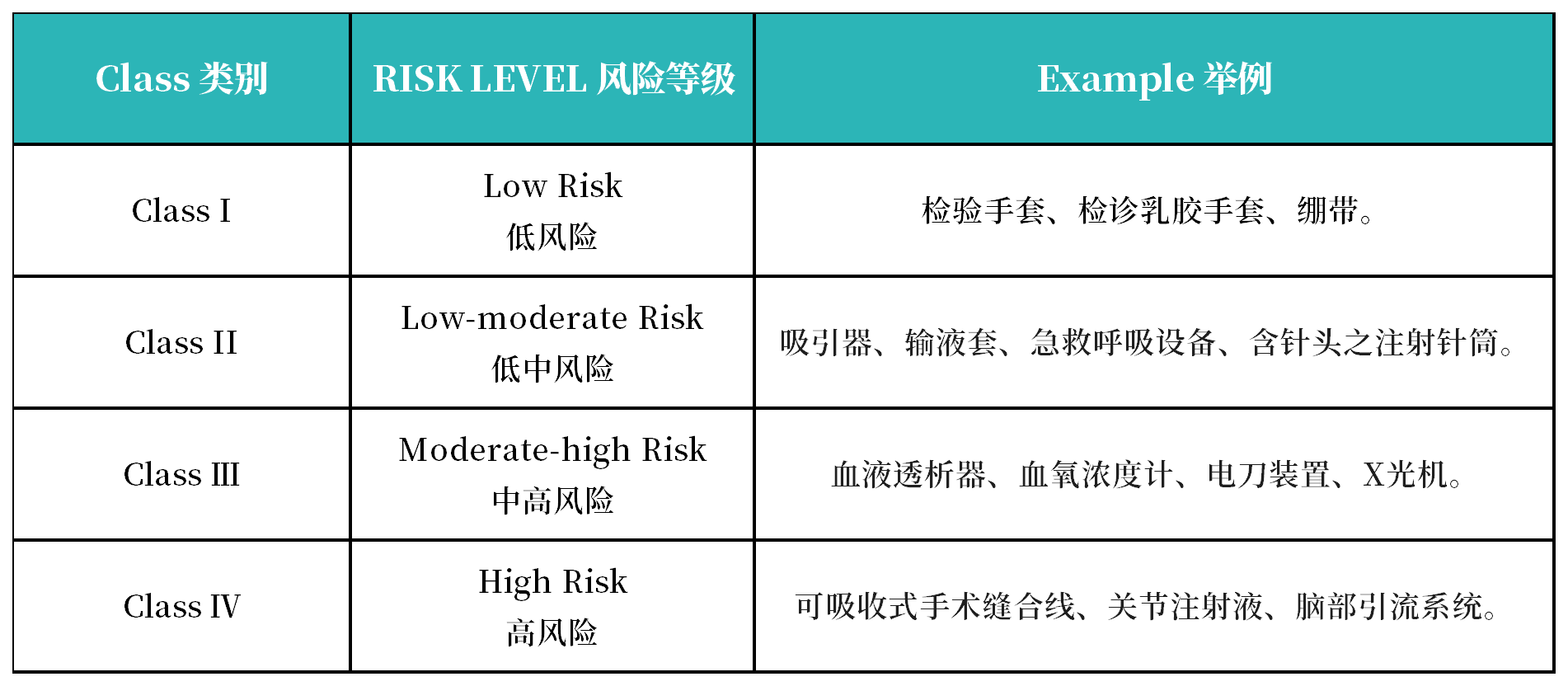
3. 医疗器械和IVD产品风险等级分类
根据秘鲁药品和药物管理局的规定,医疗器械分为Class I、Class II、Class Ⅲ、Class Ⅳ:
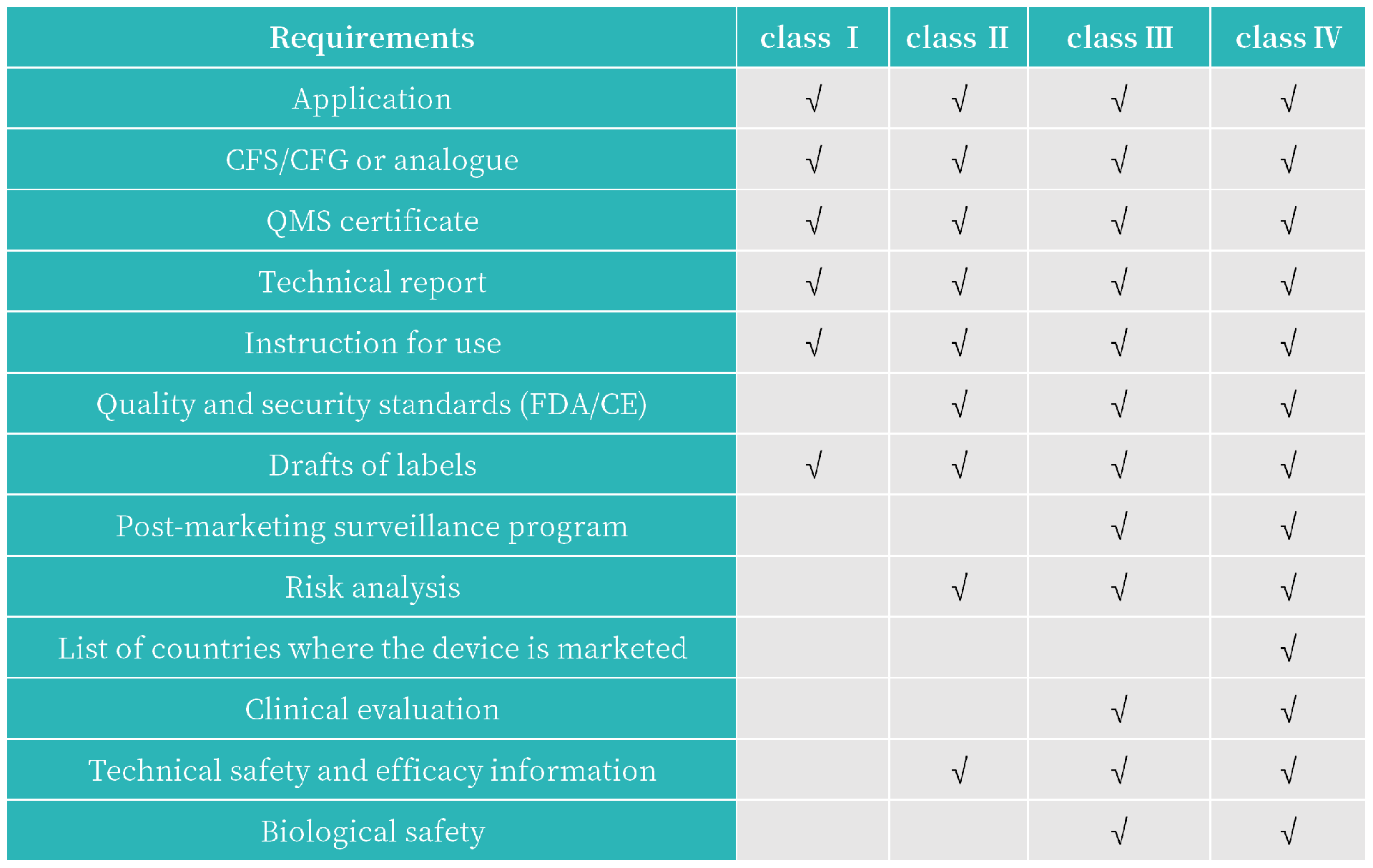
4. 准入必要条件
MD和IVD都需要ISO13485证书,以证明实际制造场地的质量体系;
对于设在秘鲁以外的制造商,还需要指定一名授权代表作为秘鲁注册持有人(PRH);
申请人需要准备详尽的产品技术规格说明书、制造工艺、材料使用等信息,以便审核机构评估产品的质量和安全性。
注册文件:
5. 注册语言
西班牙语
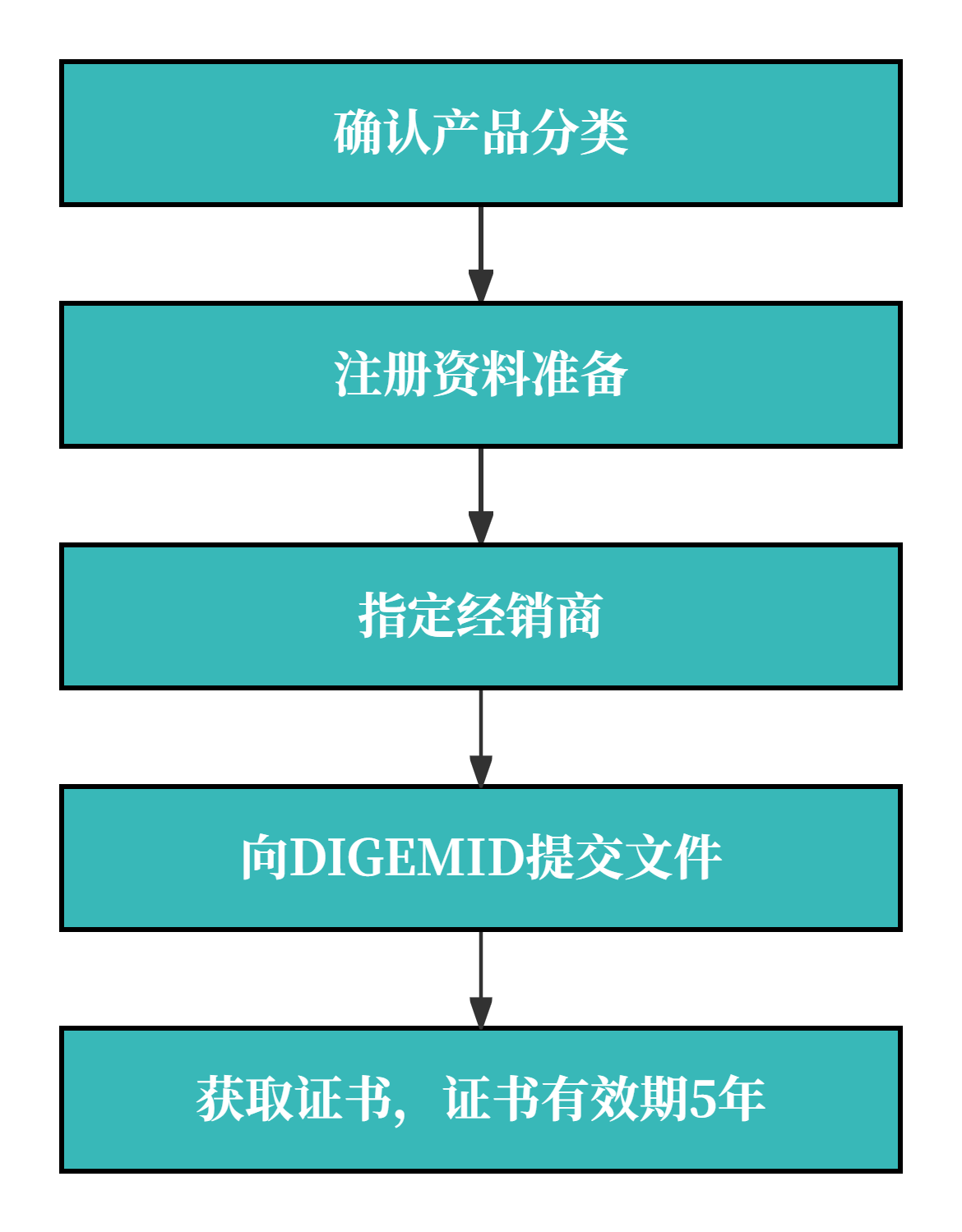
二、 注册流程,周期&官费
1. 注册流程图
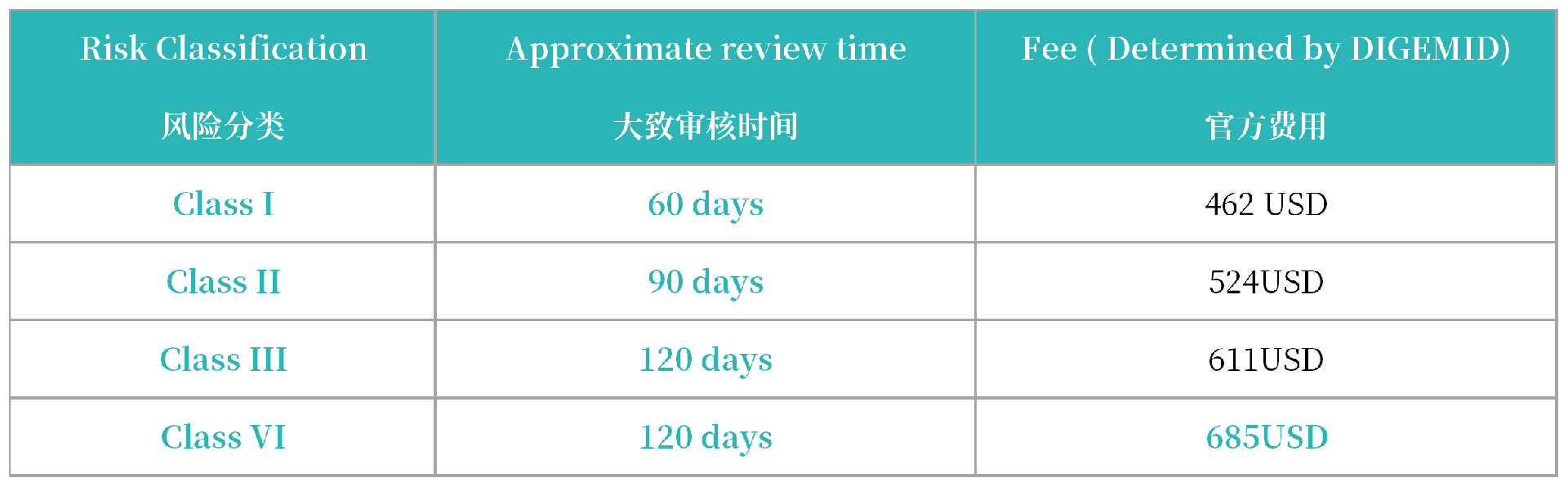
2. 注册周期及官费
注册周期
三、 FAQ
Q:对于已经获得秘鲁注册证书的医疗器械或IVD产品,如果产品发生变更,应该怎么办?
A:根据第 016-2011- SA 号最高法令 (经修订) 批准的《药品、医疗器械和医疗设备注册、控制和卫生监督条例》第 36 条的规定,对有条件卫生注册的药品和生物制品的变更进行分类。
轻微的变更只需通知国家卫生局即可,国家卫生局无需发布任何公告。医疗器械证书持有者应可在发出通知次日起六个月内实施相应变更。
对于重大变更,医疗器械证书持有者应向国家药品、医疗器械和医疗设备管理局 (ANM) 提出变更申请,ANM有最长三十个自然日的时间来解决申请。该局给予最多六个月的时间对申请的变更进行调整。
Q:医疗器械在秘鲁注册完成之后有效期是多久?
A:五年。

