一、 埃塞俄比亚EFDA监管信息简介
1. 监管局及简介

埃塞俄比亚医疗器械注册的监管机构为埃塞俄比亚食品、药品和医疗器械管理局Ethiopian Food and Drug Authority(EFDA),隶属于卫生部。
EFDA主要负责医疗器械的市场准入、质量管理、上市后监管等。
2. 监管法规
[ Food and Medicine Administration Proclamation 1112 ]
[GUIDELINE FOR REGISTRATION OF MEDICAL DEVICES]
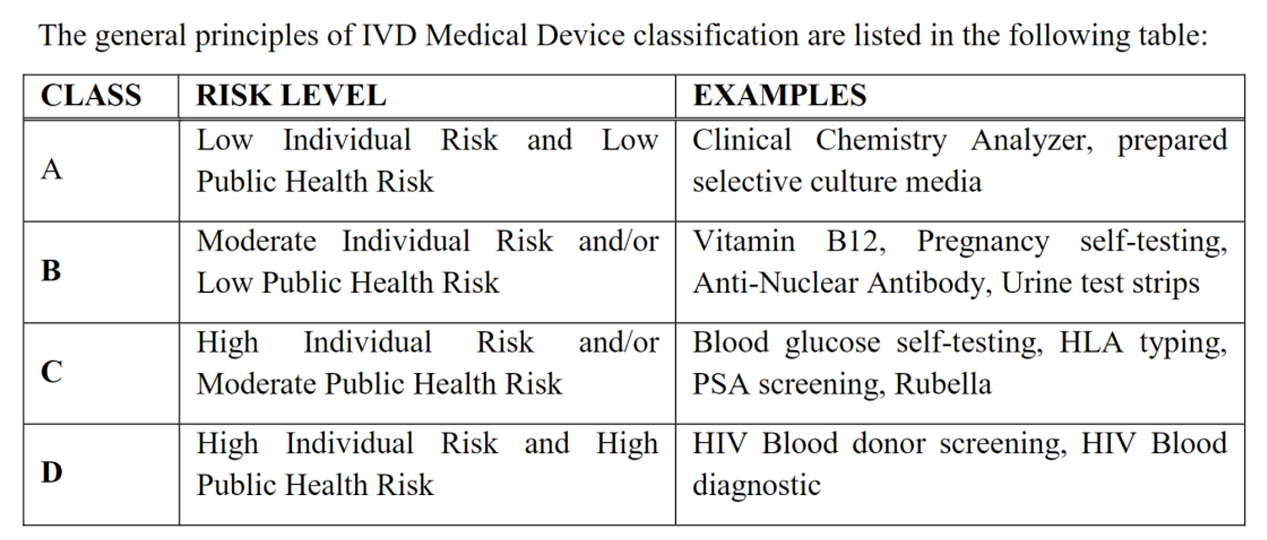
3. 医疗器械和IVD产品风险等级分类
医疗器械分类:
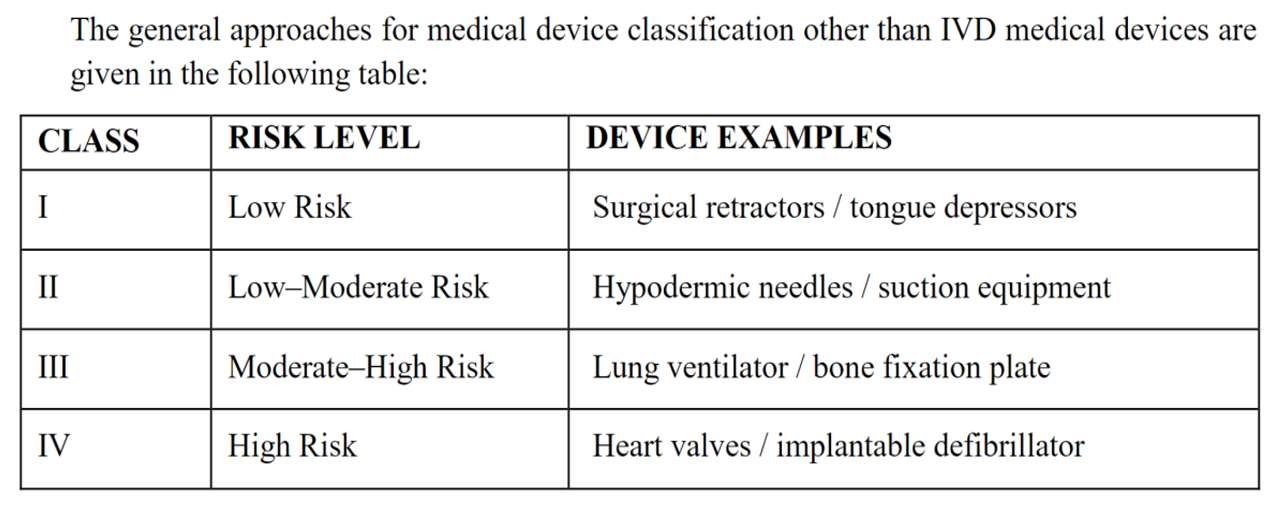
IVD 产品分类:
4. 准入必要条件
ISO 13485证书
产品信息,包括包装和标签,适用范围涵盖的设备列表,以及相关附加信息
埃塞俄比亚授权代表:授权书和代理协议
自由销售证明或上市许可证明
符合性声明(DOC)
5. 注册语言
英语
6. 埃塞俄比亚授权代表
外国制造商应任命一名埃塞俄比亚当地代表,负责代表制造商与监管机构提交申请并与其沟通。
当地代表在进口医疗器械产品时应持有由EFMHACA颁发的进口许可证书。
申请程序必须由当地代表执行。
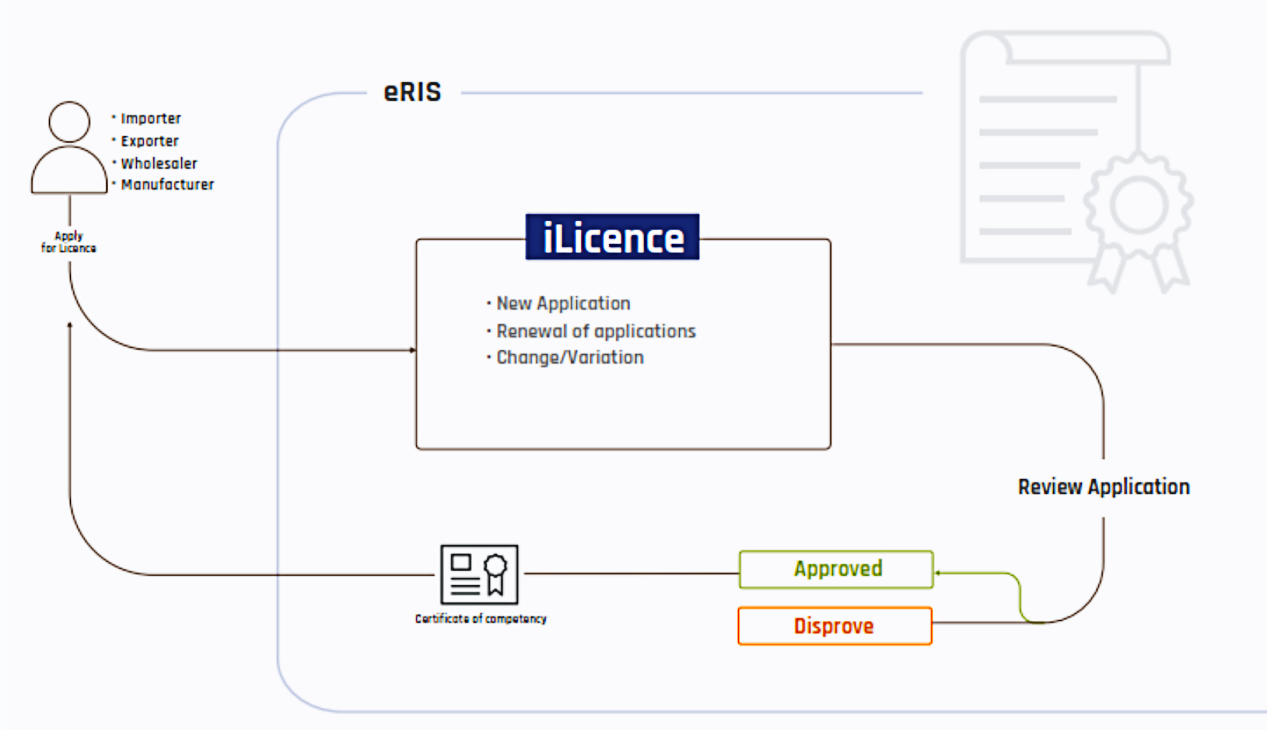
二、 注册流程,周期&官费
1. 注册流程图
2. 注册周期及官费
注册周期
新产品注册: 65美元(含文件预审及评估)
官方费用
新产品注册: 65美元(含文件预审及评估)
细微变更: 15 美元
主要差异变更: 20 美元
年度保留费(续订): 30 美元
三、 FAQ
Q:埃塞俄比亚医疗器械的延续注册应该如何进行?
A:四年后到期前 120 天申请,提交监管局所需数据或文件以确保设备持续合规。
Q:医疗设备注册申请中的变更何处理?
A:变更:若有任何可能影响医疗设备安全性或有效性的重大变更,如制造过程、设施、设备、质量控制程序、设备设计、预期用途等方面的改变,需告知管理局并获得批准后方可实施。其他变更应立即通知管理局,可在未经事先批准的情况下实施。
修正申请:对现有注册产品的修正申请(如添加产品),在文件方面通常视为新申请,但某些行政文件(如机构协议和公司简介)可能不需要。申请人应根据拟议的产品类别,遵循本指南的相应章节准备文件。所有变更和修正申请均应以书面形式提出,并附上相应费用。

