一、 孟加拉DGDA监管信息简介
1. 监管局及简介

孟加拉国的医疗器械注册由药品管理局( Directorate General of Drug Administration, DGDA ) 管理。主要负责医疗器械的法规制定、市场准入、进口许可证批准、上市后监管。
2. 监管法规
Drugs Act 1940
Drug (Control) Ordinance 1982
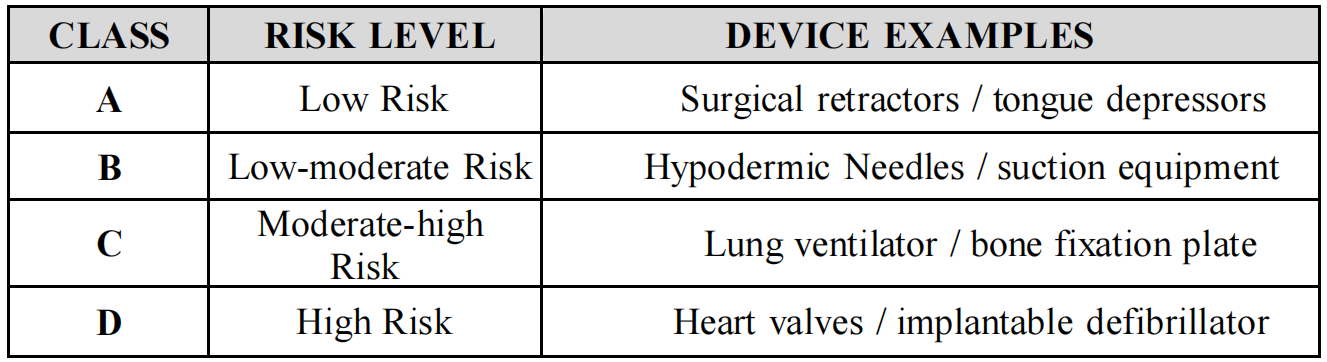
3. 医疗器械和IVD产品风险等级分类
孟加拉国注册医疗器械根据风险等级分为 Class A、Class B、Class C 和 Class D 四类:
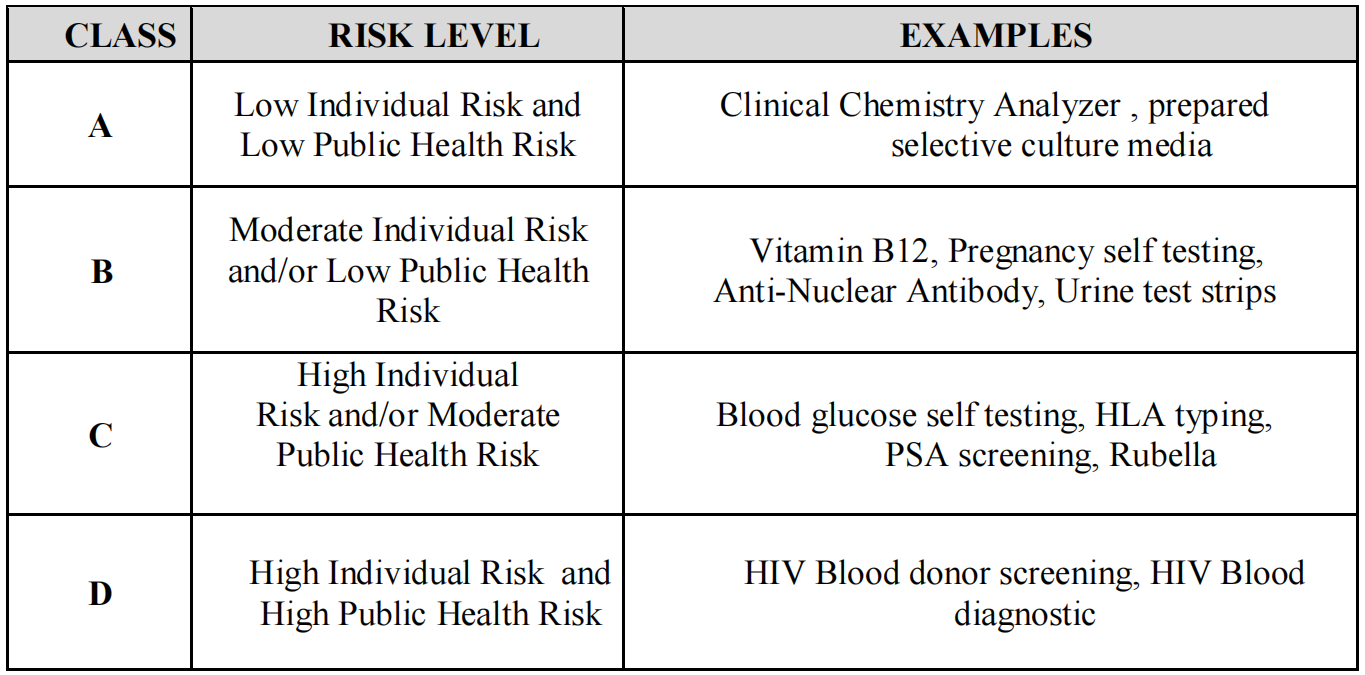
根据相关法规与指南,IVD产品的风险等级在孟加拉被分为Class A、Class B、Class C 和 Class D 四类:
4. 注册依据
孟加拉国医疗器械注册对于不同风险等级产品有不同的要求:
①A类和B类器械需参考原产国出具的自由销售证明和ISO 13485 质量管理体系证书。
②C类和D类产品需要参考国家(欧盟、美国、加拿大、日本、澳大利亚)的自由销售证书 (FSC) 和 ISO13485质量管理体系证书。
5. 注册语言
英语
6. 孟加拉持证人
孟加拉国医疗器械进口许可证将颁发给能够代表制造商的当地有相关资质的公司,并且同一医疗器械不允许同时有多个许可证持有者。
二、 注册流程
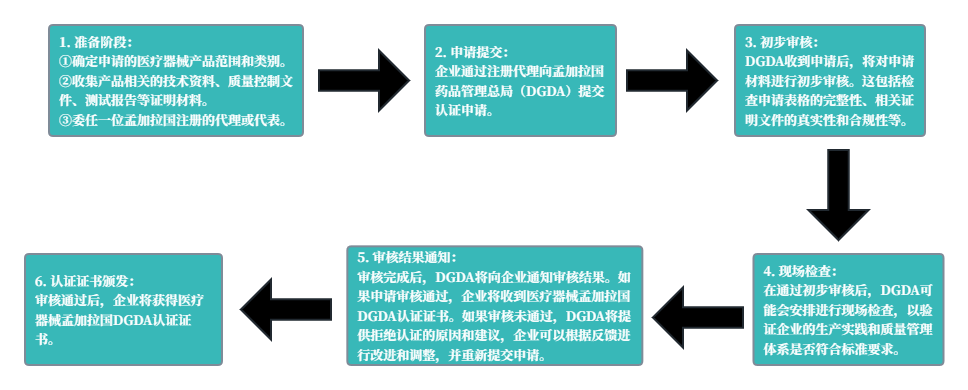
三、 注册周期与官费
1. 注册周期
以下为注册周期,具体周期长短根据产品复杂程度决定。
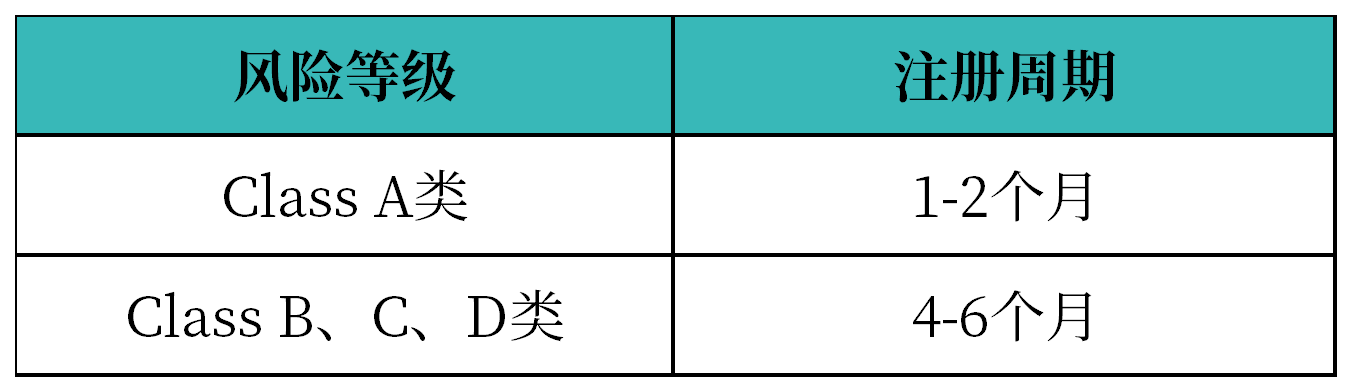
2. 注册官费
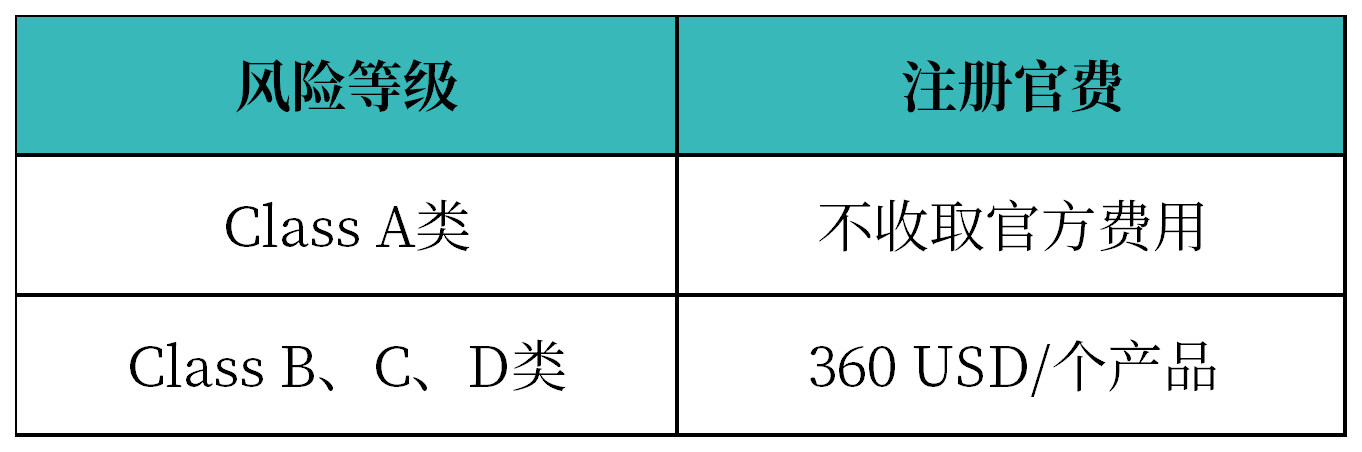
四、FAQ
Q:医疗器械产品在孟加拉国注册需要多长时间?
A:不同风险等级所用的时间会有差异,A类在1-2个月即可批准,其他风险等级产品要结合监管局的评审工作量来确定,一般会在6个月到18个月之间。
Q:医疗器械进行孟加拉国注册需要QMS证书吗?
A:需要 ISO13485质量管理体系证书。
Q:孟加拉国医疗器械注册证书有效期是多久?
A:5年。

