一、 韩国监管信息简介
1. 监管局及简介
韩国卫生福利部(Ministry of Health and Welfare,MHW),简称卫生部,主要负责管食品、药品、化妆品和医疗器械的管理。依照《医疗器械法》,韩国卫生福利部下属的食品药品安全部(Ministry of Food and Drug Safety,MFDS)负责对医疗器械的监管工作。
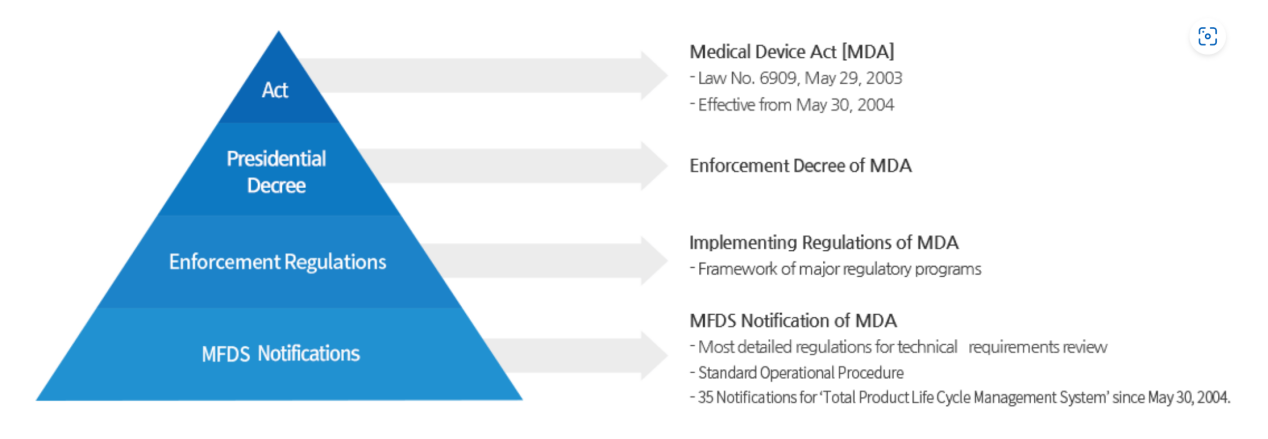
2. 监管法规
[ Medical Device Act [MDA] ] <医疗器械法>
[Enforcement Decree of MDA.] <医疗器械法实施法令>
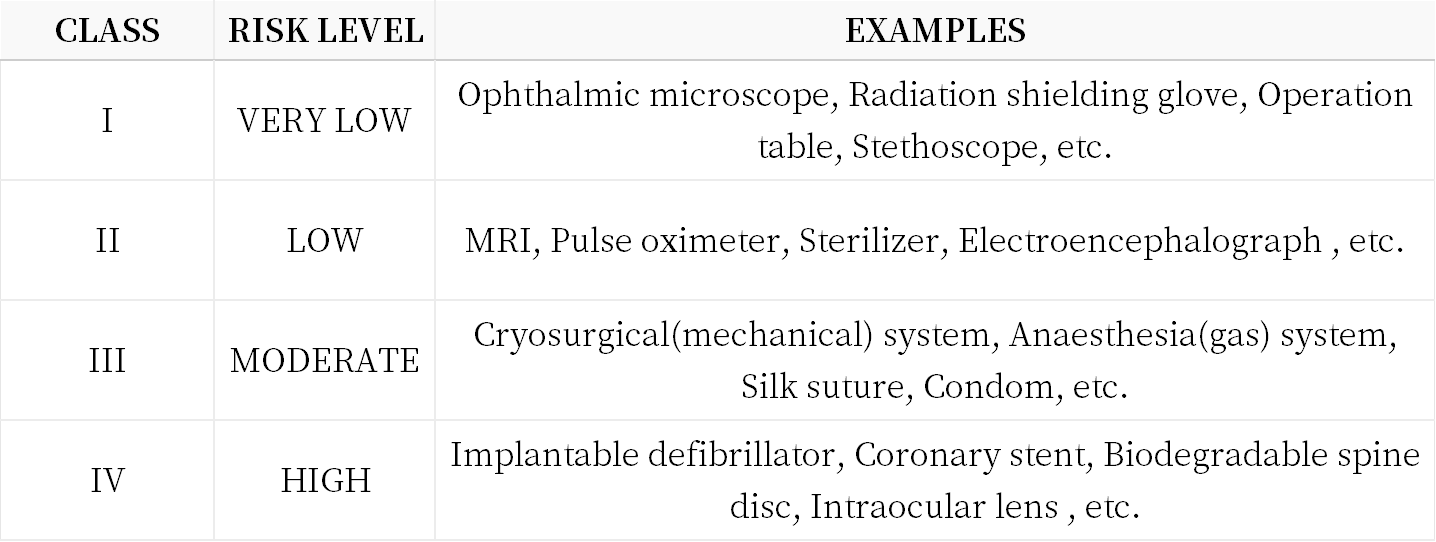
3. 医疗器械和IVD产品风险等级分类
【Medical Device (except IVD)】
【IVD】

4. 准入必要条件
MFDS 要求提交“技术文件”以进行医疗器械的认证和批准。
医疗器械在韩国的认证和批准过程需要提交:技术文件包括与医疗器械质量相关的信息,如性能、安全等,其中包括“预期用途”、“作用机制(MoA)”、“操作(功能)结构”、“原材料”、“使用说明”、“测试规范”等。
KGMP除I类产品以外,都需要获得KGMP证书。
5. 语言
韩语与英语
二、 注册流程,周期&官费
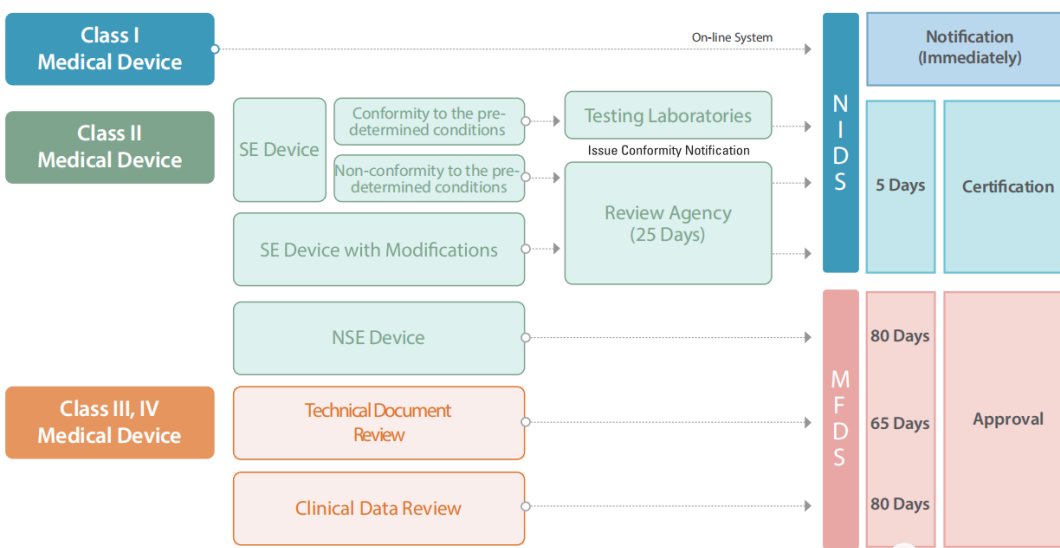
1. 注册流程图


2. 注册周期及官费
3. 注册时间
基于医疗器械的风险分类,每一类器械都有不同的市场准入途径(根据Wiselink项目经验)。
I类器械的官方审核时间约为2个月,II类器械约为4-7个月,III、IV类约为145个工作日。
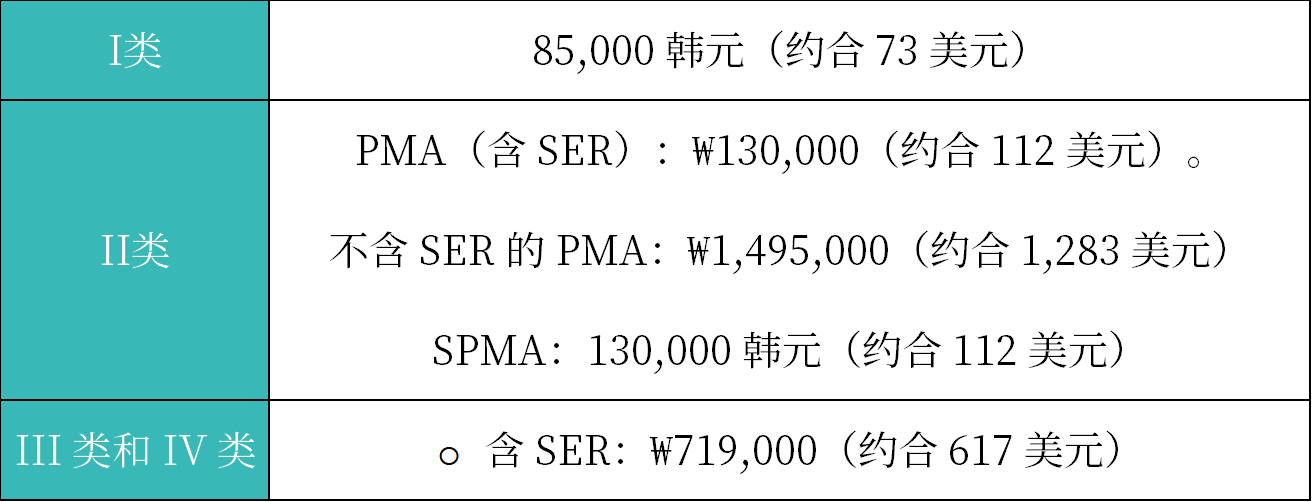
4. 注册费用
三、 FAQ
Q:医疗器械在韩国进行注册都是由MFDS进行审批吗?
A:韩国医疗器械注册主要由MFDS进行审批,但不同风险等级的审核机构有所不同。
①I类医疗器械:由医疗设备信息和技术支持中心(MDITAC)进行认证,审核时间约为2个月。
②II类医疗器械:由MDITAC进行认证,审核时间约为4-7个月。此外,II类器械的认证方式与美国FDA的510K类似,通过比对产品证明产品安全及有效性。
③III类和IV类医疗器械:由MFDS直接批准,审核时间约为145个工作日。III类和IV类器械需要进行安全性和有效性审查。
Q:韩国哪些医疗器械需跟踪控制?
A:共计52 种,包括植入人体超一年的 48 种及 4 种可在医疗设施外使用的生命维持器械,相关方需按规定记录保存,记录内容包括产品数量、日期、使用者等信息。
Q:韩国的产品注册证书可以转让吗?
A:可以。
Q:韩国产品注册证书的有效期是多久?
A:韩国医疗器械注册证书的有效期通常是5年。到期后,制造商需要申请重新注册或续期,以保持产品的市场销售资格。续期申请需在注册有效期结束前提交,以避免注册失效和市场销售中断。
在续期过程中,韩国食品药品安全处(MFDS)可能会要求更新的技术文件、测试数据或其他相关信息。续期申请需要在注册证书到期前提前递交,以确保在有效期结束前获得续订批准。
Q:有GTHF可以加快韩国审核吗?
A:GTHF的规则本身并不直接加快韩国的审核流程。然而,了解并遵循GHTF的规则有助于企业更好地准备注册材料,提高注册申请的质量,从而可能间接提高注册效率。
首先,虽然韩国在医疗器械注册方面会参考GHTF的分类和原则,但具体的注册要求和流程还是由韩国本国法规来决定的。
其次,为了加快医疗器械的注册审核,韩国MFDS提供的快速通道或优先审查机制通常是基于产品的紧急程度、创新性或重要性等因毒来考虑的,而不是基于企业是否了解GTHF的规则。
Q:韩国的KGMP体系证书可以转让吗?
A:可以。但是需要原持证人同意及授权,且需要公证。
Q:韩国KGMP会进行制造商现场审核吗?
A:KGMP认证需要进行制造商现场审核。
根据韩国《医疗器械法》,III类和IV类医疗器械需要经过MFDS的批准程序,而I类和II类设备则分别由医疗器械信息和技术援助中心(MDITAC)和MFDS进行认证和批准。制造商必须经过MFDS认可的机构现场审核后才能获得KGMP证书。
其中,II类、III类和IV类医疗器械制造商需要进行质量体系合格评定,确保其质量体系符合KGMP标准。对应的制造商必须接受现场审核,以验证其生产过程和管理体系是否符合KGMP的要求。
此外,为了简化审核流程,MFDS允许使用医疗器械单一审核计划(MDSAP)的审核结果进行桌面审核,但这仅适用于初始审核、附加审核和变更审核,延续审核仍然必须进行现场审核。

