一、 印尼MOH监管信息简介
1. 监管局及简介
印度尼西亚负责医疗器械监管的主要政府机构是卫生部(Ministry of Health Republic of Indonesia ,简称MOH)。该机构负责医疗器械上市前和上市后评估、标准化、立法和良好生产规范(GMP) 认证。
根据《2022 年印尼卫生部令》第 5 号第 5 条,印尼卫生部MOH履行以下职能:
①制定、确定和执行公共卫生、疾病预防和控制、卫生服务、药品、医疗器械和卫生人员等领域的政策协调任务的执行,为卫生部内的所有组织机构提供指导和行政支持;
②管理由卫生部负责的国家财产;
③监督卫生部职责的执行情况;
④对各地区执行卫生部事务的情况进行技术指导和监督;
⑤制定并提供卫生发展政策建议;
⑥为卫生部的所有部门提供实质性支持。
进入印度尼西亚共和国境内的任何医疗器械、体外诊断医疗器械和 PKRT(Perbekalan Kesehatan Rumah Tangga,家庭保健品,简称 PKRT)产品,医疗器械在印尼市场上销售需要进行注册,并取得相应的注册证。
2. 监管法规
Regulation of the Minister of Health No. 62 of 2017 concerning Medical Devices and Household Health Supplies :
该法规规定了医疗器械的注册、分类、生产、销售和监督的要求,涵盖了医疗器械的定义、分类标准、注册程序和市场准入要求等。印尼参考的东盟相关法规(如东盟医疗器械指令)、具体的注册和监督指南等。
3. 医疗器械和IVD产品风险等级分类
根据使用医疗器械对患者可能造成的风险,按照从低到高分为:
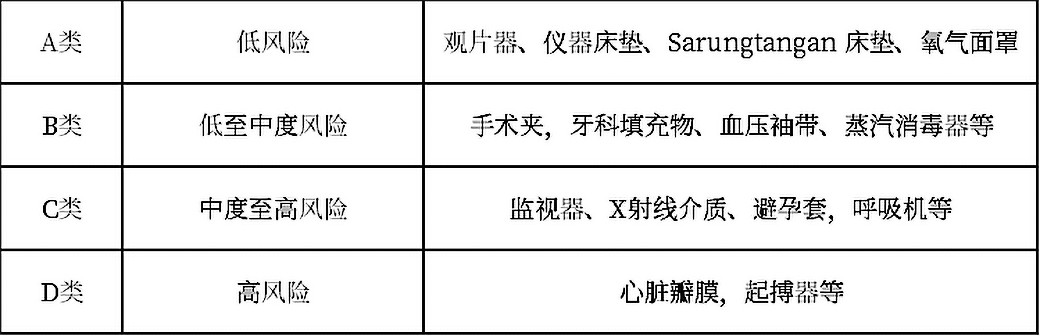
根据对个人和公众的检查结果的误解风险,体外诊断医疗器械分为:

4. 准入必要条件
外国制造商在印尼销售医疗器械时,必须委任唯一一个当地代理。这个代理将承担起产品注册、销售以及售后服务的本地责任。
建立符合ISO 13485 的质量管理体系,以确保产品质量。
准备详细的技术文件,基于东盟通用提交档案模板(CSDT)进行准备,并符合印尼的法规和标准要求,包括产品设计、规格、制造工艺、材料成分、性能特点、临床试验数据(如适用)等。
对于某些高风险或特定的医疗器械,可能需要提供临床试验数据以证明产品的安全性和有效性。临床试验需由经过批准的机构进行,并符合伦理和法规要求。
5. 注册语言
英语+印尼语
6. 印尼Sole Agent/Sole Distributor/Exclusive Distributor
独家代理/独家分销商/独家分销商是指由生产商或制造商或委托人指定的 PAK 或 PKRT 进口商,作为代表在印度尼西亚共和国境内注册和分销医疗器械、体外诊断医疗器械和 PKRT,并提供医疗器械、体外诊断医疗器械和 PKRT 的售后服务。
如果产品许可证申请是由被指定为独家代理/独家分销商/独家分销商和/或授权注册的PAK或PKRT公司提交的,则产品许可证的有效期与该指定或授权的有效期相同。
在下列情况下,产品许可证被宣布无效:
①产品许可证过期;
②生产证书过期;
③PAK 许可证过期;
④总代理/总经销商/独家经销商和/或授权过期或未延期;或
⑤产品许可证被撤销。
二、 注册流程
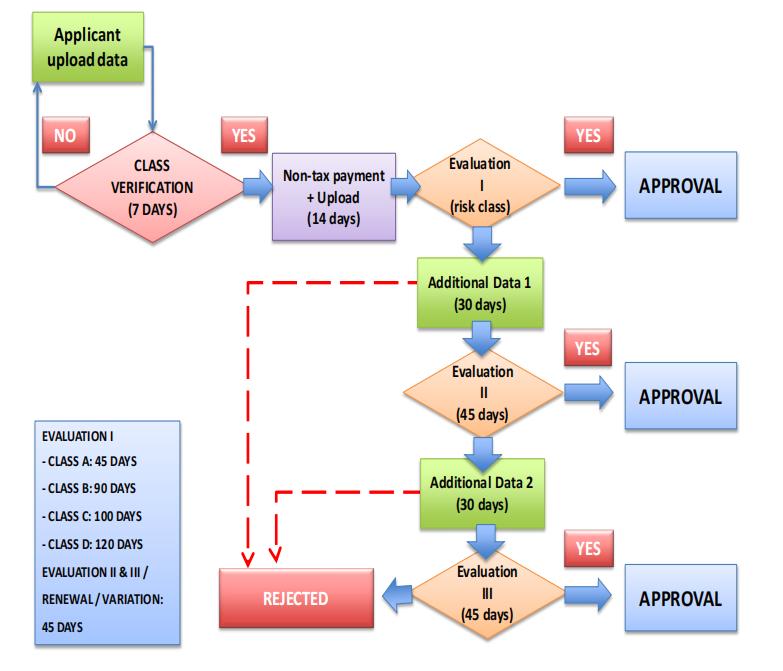
1. 注册流程
预注册阶段,预注册是评估员对医疗器械的分类风险进行验证,以确定非税收入费用的过程。
①申请者应按要求通过网站 http://www.regalkes.depkes.go.id。预注册评估结果将通过网站和电子邮件通知。申请人应积极查看并核对评估结果。
②评估员应在最多 7 天内对医疗器械进行风险分类。
③申请人将收到非税收入费用的电子邮件通知,该费用必须根据医疗器械的分类支付。
④申请人必须在收到非税收费用通知后 14 天内支付非税收费用并上传付款收据。
⑤在预注册阶段,尚未开始针对数据完成情况的评估和验证。
不符合要求的注册文件将给予两次提交补充数据的机会,并且每份补充资料应在提交后30天内完成。
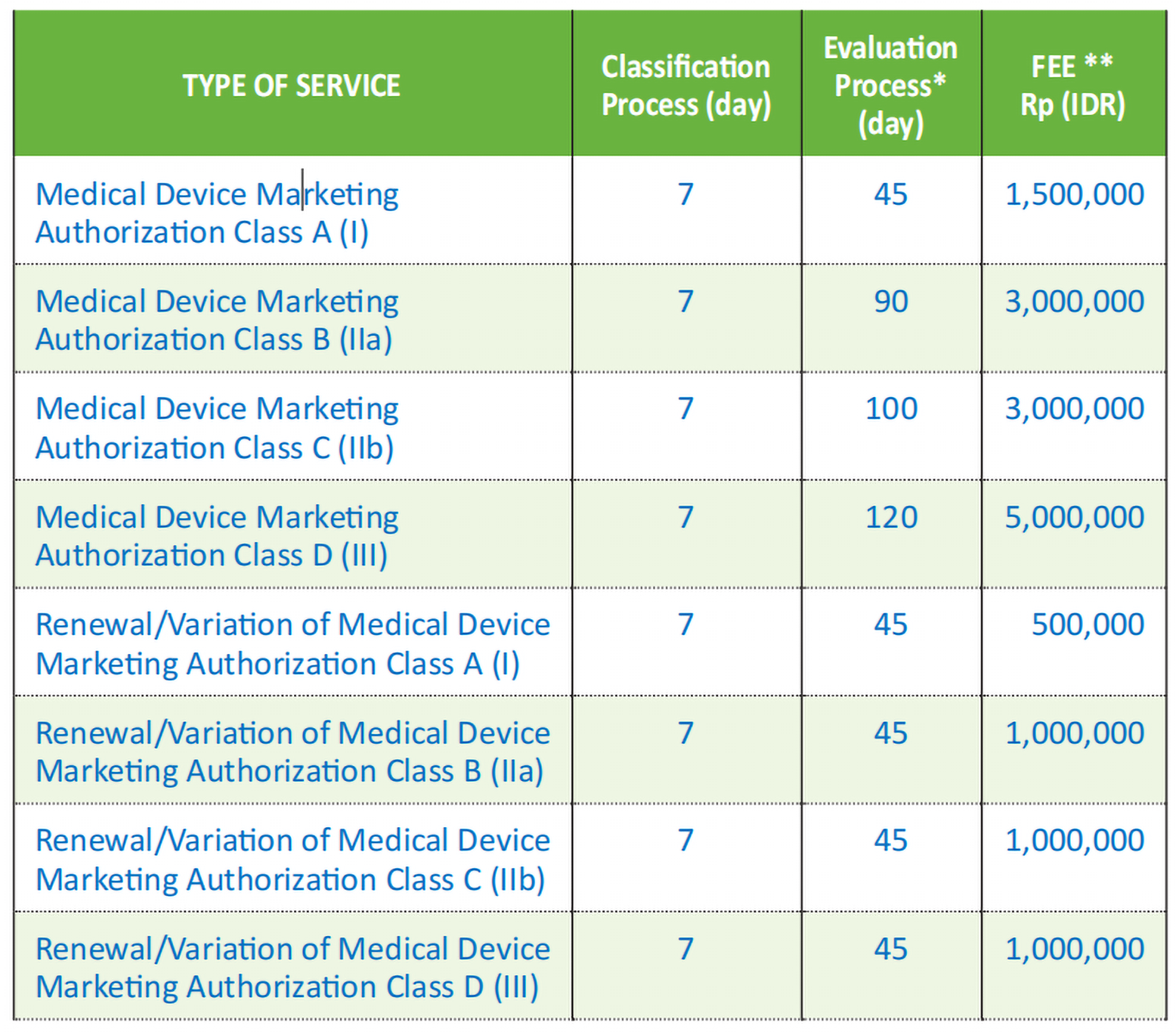
2. 注册周期及官费
获得上市许可的要求和时间长度取决于医疗器械的风险分类。
三、 FAQ
Q:在哪里提供许可EDAR HeALTH TOOLS
A:在实施透明和负责任的公共服务方面,医疗器械经销许可证的注册申请可通过网站 http:// www.regalkes.depkes.go.id 和/或印度尼西亚卫生部综合服务部进行在线申请。
Q:医疗器械进行印尼注册需要QMS证书吗?
A:如果医疗器械在印尼注册时,制造商必须建立和维护适当的质量管理体系,如符合 ISO 13485 标准,以确保产品的制造和质量控制过程符合国际标准。
Q:印尼医疗器械营销授权的服务类型
A:医疗器械新产品申请、医疗仪器续期申请、医疗器械变更申请、更改医疗仪器续期申请。
Q:印尼医疗器械营销授权的有效期是多久?
A:营销授权续期的有效期将与授权书(LoA)一致,授权书的有效期最短为 2 年,最长为 5 年。
Q:印尼可以更换授权代表吗?
A:可以。在印尼企业信息变更包括公司地址、联系方式、授权代表等的变更,属于医疗器械在印尼进行 BPOM 注册后的变更管理范畴。
进行授权代表变更时,通常需要准备相关材料并通过一定的程序。具体来说,可能需要提供变更说明、新授权代表的相关资质文件等,并通过 BPOM 的在线系统(如 e-bpom)提交变更申请。
Q:一个产品可以同时被多个授权代表注册吗?
A:不可以。2017 年Permenkes 第 62 条第 13 条每种类型的医疗器械、体外诊断医疗器械和进口PKRT,带有 1(一)个源自制造商或委托人的商标/品牌名称,只能由一 (1) 个 PAK 或 1(一)个 PKRT 进口商代理。 一个品牌、一种类型不能由不同的经销商代理。
Q:印度尼西亚医疗器械可以变更和延期吗?
A:可以。可在许可证有效期内变更销售许可,变更应通过在线系统http://www.regalkes.depkes.go.id 选择变更菜单进行。
四、 Wiselink印尼子公司Wiselink ID营业执照