一、 背景信息
1. 简介

MDSAP(Medical Device Single Audit Program),是指美国(FDA)、加拿大(Health Canada)、巴西(ANVISA)、澳大利亚(TGA)和日本(PMDA)五个国家医疗器械单一审核计划。它的目标是通过一次性审核,评估医疗器械制造商质量管理体系,以确保其产品符合参与国家的法规要求,企业完成MDSAP认证后可以显著减少监管机构的审核次数,降低因审核带来的生产干扰,减轻企业的负担。
2. 参考文件
MDSAP AUDIT APPROACH
3. MDSAP评级系统
在MDSAP审核期间,不合格项评级分数为1-5分,通过不合格评分矩阵升级规则来确定最终评分。不合格评分会记录在“标准不合格评级和交换表”,表格中也包括如何根据ISO 13485获得最终不合格评分的详细信息。
4. 申请依据
MDSAP认证申请不依赖于是否获得其他质量体系认证证书,但如果有ISO 13485基础将会使得MDSAP认证更加顺利。
5. 申请认证语言
英语
6. 可以开展MDSAP认证的审核机构AO(Auditing Organization)
目前有15家审核机构可以颁发MDSAP认证证书:BSI、DEKRA、DNV MEDCERT GmbH、DNV Product Assurance As、DQS MED、GMED、IMQ、Intertek、NSAI、NCC、SGS、TUV USA、TUV SUD、UL LLC。
二、 认证流程
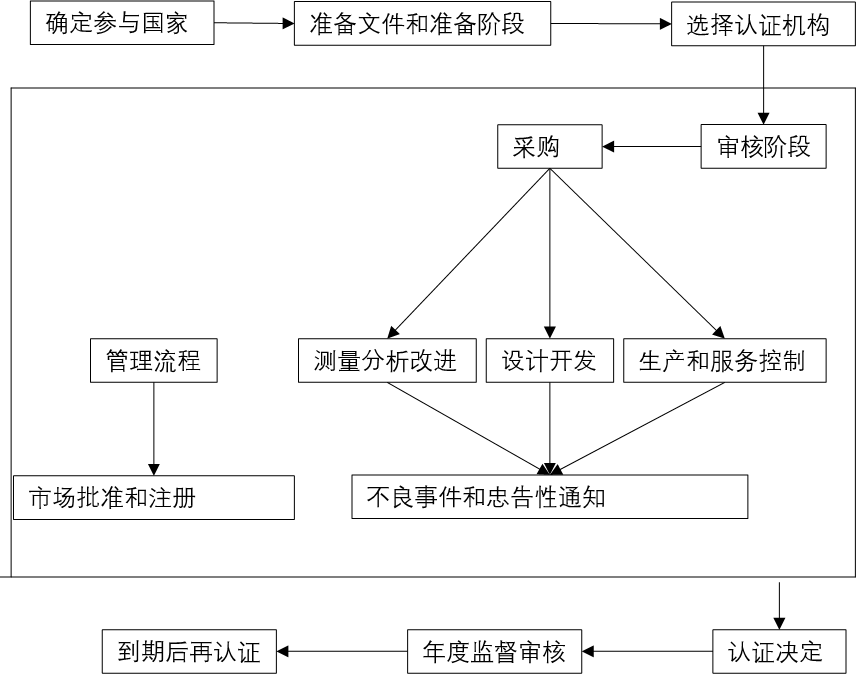
文件准备:公司基本信息与申请表、质量管理体系文件、已导入目的国法规要求的相关文件、设计和开发文件、生产和制造文件、售后服务文件、风险管理文件、内部审核记录、相关法规和标准的合规证明。
三、 FAQ
Q:MDSAP必须申请5个国家吗?
A:MDSAP的申请范围可以根据企业的目标市场而确定,如果已经或者计划在该市场销售了某种医疗器械,就应该将该国纳入申请范围中,值得注意的是,加拿大法规要求如果连续3年内没有在加拿大有任何销售行为,AO将从MDSAP认证范围中移除加拿大。
Q:MDSAP认证的费用是怎样的?
A:MDSAP认证费用与公司规模、申请范围相关,不同AO的报价略有差异,可以将企业具体信息提交给AO后得到完整报价。
Q:MDSAP的推荐文件和指南文件有哪些?
A:企业可以在FDA官网的MDSAP国际专题找到MDSAP相关指导文件https://www.fda.gov/medical-devices/cdrh-international-programs/medical-device-single-audit-program-mdsap 。
另外有以下文件可以参考:
Questions and Answers on the Medical Device Audit Program
MDSAP Audit Procedures and Forms-MDSAP-AU-P0002.009-2024
MDSAP International Regulations
Recent Announcements

