一、 乌兹别克斯坦MOH监管信息简介
1. 监管局及简介

乌兹别克斯坦的监管部门为乌兹别克斯坦共和国卫生部(MOH)下属国家机构药品安全中心(Center for Pharmaceutical Products Safety),该机构负责乌兹别克斯坦境内的医疗器械准入和监管事务,包括制定和实施医疗器械法规、标准和指南,审批医疗器械注册申请,监督上市后流通和使用等 。
2. 监管法规
О лекарственных средствах и фармацевтической деятельности (《药品和制药活动法》)及其相关修正措施。
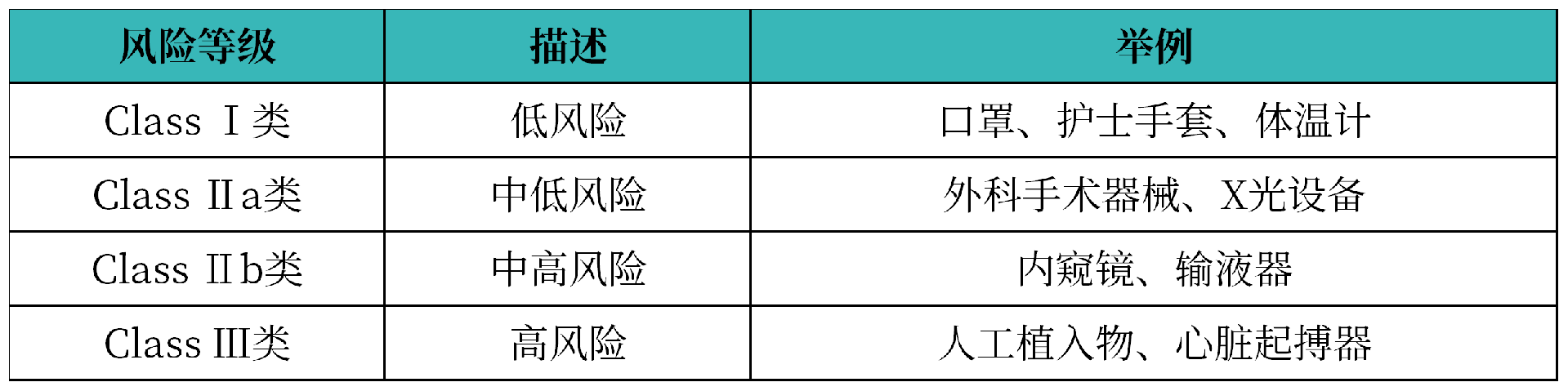
3. 风险等级分类
药品安全中心使用与欧盟国家相同的基于风险的分类模型,将医疗器械分为以下几类:Class I类、Class IIa类、Class IIb类和Class III类:
4. 注册依据
ISO 13485证书
乌兹别克斯坦认可如下国家的注册批准:
①Australian Union
②Kingdom of Belgium
③United Kingdom of Great Britain and Northern Ireland
④Germany
⑤Kingdom of Denmark
⑥Israel
⑦Ireland
⑧Kingdom of Spain
⑨Italy
⑩Canada
⑪South Korea
⑫Kingdom of the Netherlands
⑬Kingdom of Norway
⑭Slovenia
⑮United States of America
⑯Finland
⑰France
⑱Swiss Confederation
⑲The Kingdom of Sweden
⑳Japan
5. 注册语言
英语。
说明书及标签需为乌兹别克斯坦官方语言乌兹别克语或俄语。
6. 乌兹别克斯坦持证人
根据乌兹别克斯坦的法规要求,申请人即为持证人。
申请人是指向乌兹别克斯坦的监管机构申请医疗器械注册并获得证书的商业实体、法人实体(或代表其行事的授权人)。
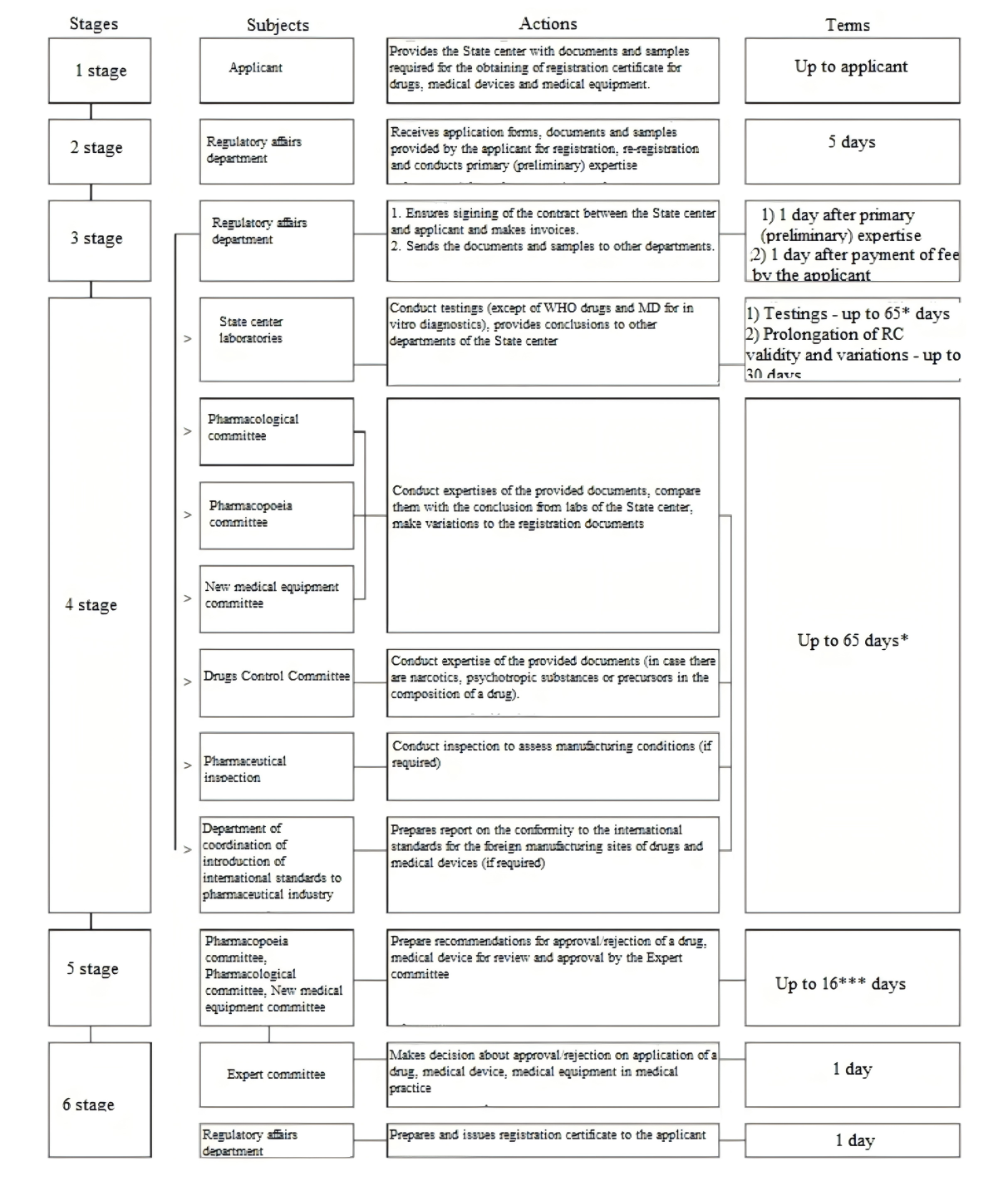
二、 注册流程图
三、 注册周期、官费
注册周期

注册官费
官方费用将会由乌兹别克斯坦医疗器械监管官方判断目标器械所属的风险等级之后确定。
四、FAQ
Q:医疗器械产品在乌兹别克斯坦注册需要多长时间?
A:乌兹别克斯坦注册可选择产品注册和注册认可两个途径:
①产品注册途径的注册需要7-9个月,需要提交CTD档案、样品和实验室测试的参考标准;
②注册认可途径是指获得欧盟,日本以及其他乌兹别克斯坦认可国家的注册证书,周期大约1-3个月。
Q:医疗器械进行乌兹别克斯坦注册需要QMS证书吗?
A:需要。
Q:医疗器械产品完成注册后可以进行注册变更吗?
A:在证书有效期内,申请人可以提交变更申请。申请必须使用相关文件进行修改。申请和注册材料的审查期限为60-90个工作日,申请人回复所需的时间不包括在总评估期内。
Q:乌兹别克斯坦的医疗器械注册证书有效期是多久?
A:5年。

