一、 俄罗斯监管部门
1. 俄罗斯RZN

俄罗斯医疗器械监管主要由其联邦医疗监督服务局Roszdravnadzor(简称:RZN)负责,也可称为FSSH(Federal Service for Surveillance in Healthcare)。负责管理和监督医疗保健系统,具体职责如下:
o 注册管理:对医疗器械进行注册,审查技术文档、临床数据、产品样品等,确保其在俄罗斯市场销售前符合安全性和性能标准。
o 法规制定和实施:制定和实施医疗器械相关的法规和标准,涉及产品设计、生产、标签和市场监管等方面,确保与国际标准接轨并适应俄罗斯实际情况。
o 质量控制和监督:进行质量控制检查,包括对生产设施的检查、生产过程的监督和产品的市场抽检等,以保证市场上的医疗器械符合注册要求。
o 投诉处理和不良事件报告:处理与医疗器械相关的投诉和不良事件报告,监控医疗器械在使用过程中出现的问题,并采取必要的措施,如召回不合格产品或修改产品说明书。
o 进口和出口管理:管理医疗器械的进口和出口,确保进口医疗器械符合俄罗斯的标准,并监督出口产品的合规性,包括颁发进口许可证和出口证明等。
o 信息和宣传:提供关于医疗器械注册、使用和监管的信息,向公众、制造商和医疗机构宣传相关政策和法规,通过官方网站和其他渠道发布最新的法规和公告。
2. 监管法规
Article 38 of the Health Law (Federal Law 323)
Decree No. 1416 Medical Device Registration Rules
Ministry of Health of the Russian Federation Order No.4n
Ministry of Health of the Russian Federation Order No.11
Ministry of Health of the Russian Federation Order No. 1353n
3. 风险等级分类

俄罗斯法令Ministry of Health of the Russian Federation Order No.4n 对医疗器械的分类作了比较详细的描述。(可联系Wiselink获取)
4. 注册依据
由于俄罗斯注册相对比较独立,俄罗斯政府不直接认可其他国家的注册证明,即使是已经通过了美国FAD认证和欧盟CE认证的产品,也必须经过注册程序才准许入境。
俄罗斯会强制要求产品在俄罗斯开展必要的测试,因此在没有任何国家注册历史的情况下也可以在俄罗斯注册。
5. 注册语言
俄语
6. 俄罗斯授权代表
俄罗斯境外制造商需要在俄罗斯本地任命一位当地授权代表才能提交注册申请,但医疗器械证书持有人可以是制造商,也可以是当地授权代表,这取决于在提交申请时选取哪一方作为证书持有人。
7. 注册文件清单
①【申请表】:通常由制造商或其授权代表(如注册代理商)提交。
②【产品描述和使用说明】:提供详细的产品描述,包括产品的功能、适应症、使用方法和技术参数。(需要提供俄文版的使用说明书,以确保符合俄罗斯语言和法规要求。)
③【产品技术文件】:包括产品的设计和制造工艺、材料成分、质量控制措施、风险管理分析等。这些文件需要符合俄罗斯标准,还可能需要提供符合ISO 13485(质量管理体系)认证的文件。此外,还需提供临床试验报告,以证明产品在特定医疗条件下的安全性和有效性。
④【制造商认证】:提供制造商的合法营业执照、生产设施的符合标准证明和其他相关资质文件。如果生产厂位于俄罗斯以外,还需提供制造商所在国家的认证和检查报告。
⑤【质量管理体系认证】:提供ISO 13485质量管理体系认证证书,或类似标准的质量体系证明,以证明制造商遵循医疗器械的质量管理要求。
⑥【产品标签和包装】:提供产品标签的样本,确保其符合俄罗斯市场的标签要求,包括标明产品名称、制造商信息、注册号、生产日期、有效期等。
⑦【产品样品】:根据要求提供一定数量的产品样品,供俄罗斯监管机构进行产品检查和评估。
⑧【其他相关文件】:根据具体产品类型,可能需要提供其他特定的认证文件,如电气安全认证、EMC(电磁兼容性)测试报告等。
⑨【注册代理商的授权文件】:如果申请人不是俄罗斯本地公司,则需要委托俄罗斯的注册代理商,并提供授权书及代理商的注册信息。
⑩【注册费用支付证明】:提交支付注册费用的凭证。费用通常与产品的类别、复杂性以及所需审批程序的详细程度有关。
⑪【产品分类和风险评估报告】:依据俄罗斯的医疗器械分类标准,提交产品的分类和风险评估报告,以确定产品的注册类别。
8. 包装|标签要求:
①俄罗斯语言标签:所有医疗器械的包装和标签必须使用俄罗斯语标注产品名称、规格、标识码、批次号、生产日期、保质期等信息。
②厂家标识:医疗器械的标签和包装上必须清晰标示生产商的名称和地址。
③使用说明书:医疗器械标签和包装上必须包含使用说明书,应该包含清晰、详细的治疗和安全指导。
④贴标签位置:标签和条形码必须按照俄罗斯标准贴在包装上。
⑤持久性:医疗器械上的标签必须牢固,不易剥落或磨损。
⑥条形码要求:医疗器械必须贴有标准的国际商品编码条形码。
二、 注册流程|官费|周期
1. 注册流程
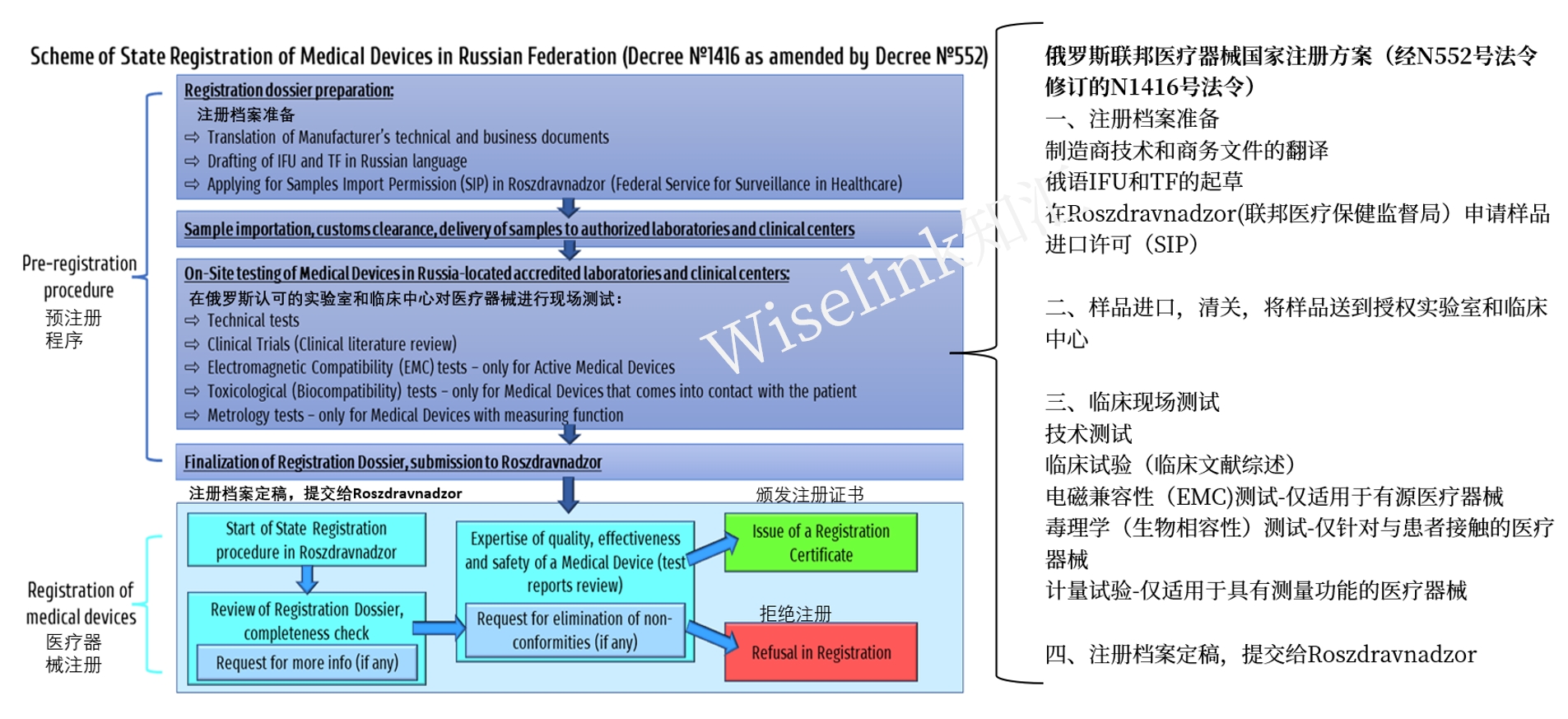
2. 注册官费及周期

三、 FAQ
Q:医疗器械产品在俄罗斯注册需要的时间和费用是怎样的?
A:俄罗斯的注册周期较长,且费用不低。除官费外的其它费用与实际项目周期可以联系Wiselink获取。
Q:医疗器械注册审核官费是固定的吗?
A:官费基本固定,但专家评审费用可能会在面对面会议中发生变化。
Q:俄罗斯注册一定需要当地测试吗?
A:需要。
Q:医疗器械进行俄罗斯注册需要QMS审厂吗?
A:从2024年1月1日起,俄罗斯联邦规定对于特定风险等级及类别的医疗器械(IIa无菌,IIb及III类)会对外国制造商(申请者)进行现场QMS核查。核查的内容包括但不限于:质量方针、质量手册、贯穿产品整个生命周期的风险管理、原材料/物料的进货检验、设计开发、生产、最终控制相关的流程方法等等,具体要求可以参考135和136号文件。
现场审核每五年一次,如企业计划注册多个产品,可考虑一次申请多个产品类别以减少现场审核的次数和成本。
Q:俄罗斯注册需要临床试验吗?
A:如果提交注册的产品尚未在俄罗斯本土有同类产品获批,则该产品需要在俄罗斯本土真实世界开展临床试验,临床试验审查通过后才会发给专家委员会进行第二轮技术评审。
Q:俄罗斯注册需要开展哪些当地测试项目?
A:需要在俄罗斯当地指定试验室,做以下测试:
①技术功能测试(local technical test);
②毒理学测试(local toxicology test);
③电气安全与电磁兼容测试(local IEC/EMC test);
④临床审查(local clinical trial);
⑤测量测试(local metrology test),如适用。
Q:俄罗斯QMS体系审厂费用是怎样的?
A:现场审查(验厂):约6-8万元人民币/工厂,不含差旅。
Q:EAEU注册已经提上日程,这对俄罗斯注册有何影响?
A:2017年5月6日正式颁发医疗产品EAEU统一注册法规,并原定于2022年1月1日强制执行,但后面经过两次延期,最终决定在2025年12月31日开始强制执行,因此俄罗斯注册(RZN)在2025年12月31日之前仍然可以提交,至于后续是否还会延期需要等官方通告。
Q:俄罗斯注册证书有效期是多久?
A:永久有效。
四、 证书模板

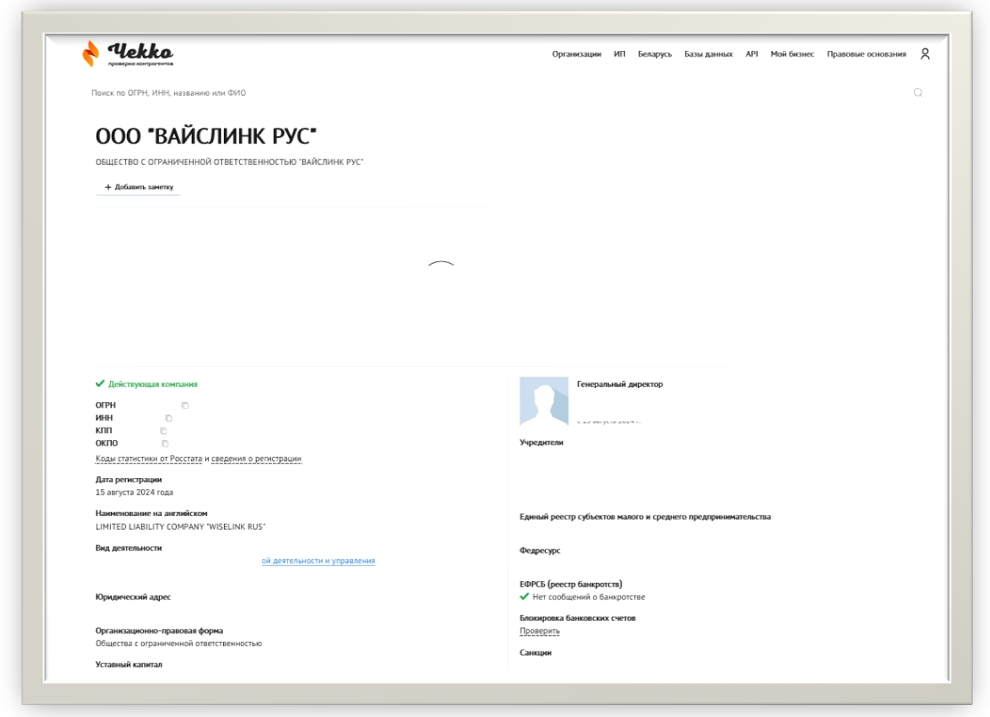
五、 Wiselink Group俄罗斯子公司Wiselink RU
LIMITED LIABILITY COMPANY "WISELINK RUS是Wiselink Group的俄罗斯子公司。