一、 塞尔维亚ALIMS监管信息简介
1. 监管局及简介

塞尔维亚药品及医疗器械管理局(Medicines and Medical Devices Agency of Serbia,ALIMS)是该国医疗器械的监管机构,负责医疗器械的市场准入、合规审批、上市后监督管理等工作。
2. 监管法规
"The Official Gazette of the Republic of serbia”, No. 30/2010 107/2012105/17 and 113/2017
"The Official Gazette of the Republic of Serbia" , No. 105/2017
EU Medical Devices Regulation (MDR)
3. 医疗器械和IVD产品风险等级分类
医疗器械:
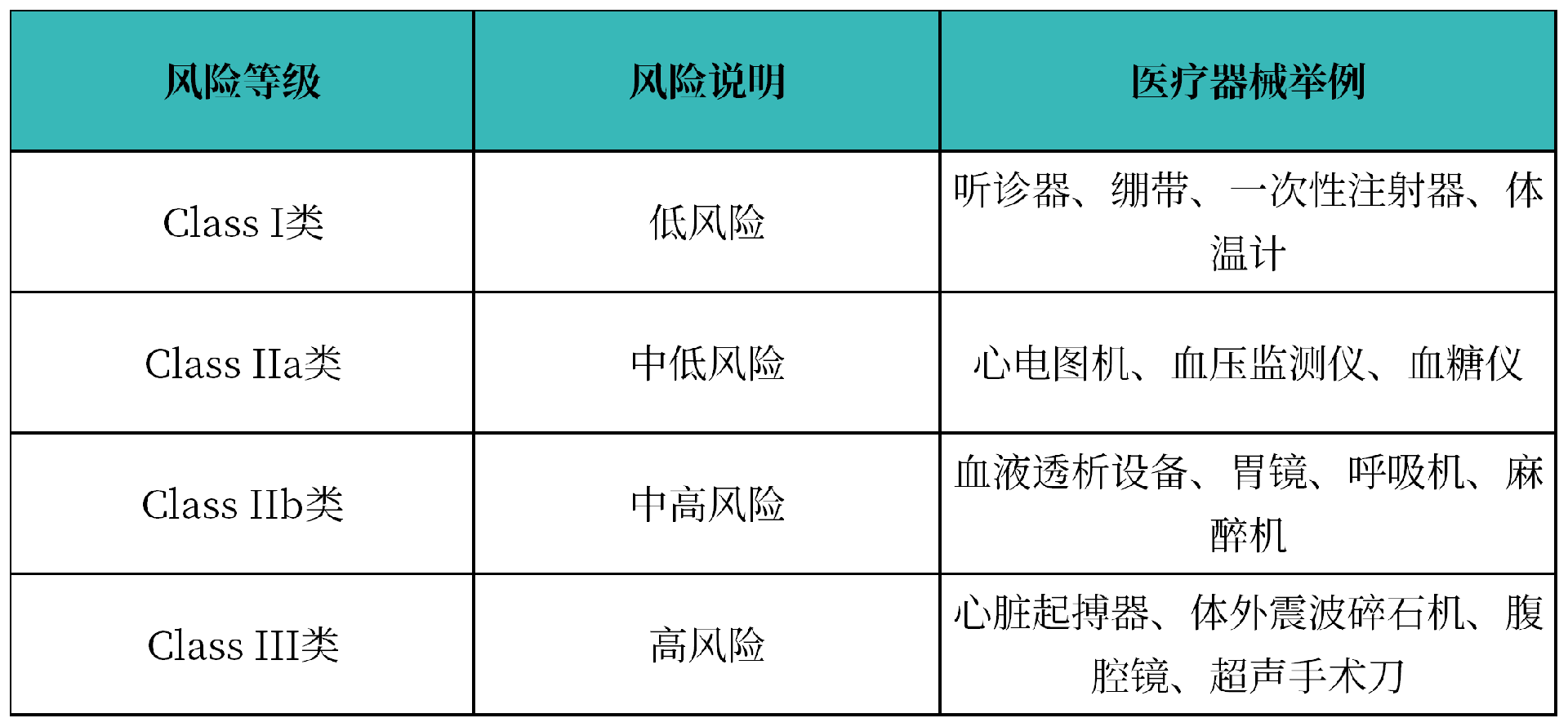
体外诊断试剂分类:
LIST A
①用于确定 ABO 血型系统、Rhesus Factor(C、c、D、E、e)“anti - Kell” 等血型的试剂和试剂产品,包括控制和校准材料。
②用于检测、确认和定量人类标本中 HIV 感染(HIV 1 和 2)、HTLV I 和 II、乙型肝炎、丙型肝炎、丁型肝炎标志物的试剂和试剂产品,以及控制和校准材料。
LIST B
①用于确定 “anti - Duffy” 和 “anti - Kidd” 等血型的试剂和试剂产品,以及控制和校准材料。
②用于检测不可接受的抗红细胞抗体的试剂和试剂产品,以及控制和校准材料。
③用于检测和量化人类标本中类似感染(如风疹、弓形虫病等)的试剂和试剂产品,以及控制和校准材料。
④用于诊断遗传性疾病(如苯丙酮尿症)的试剂和试剂产品,以及控制和校准材料。
⑤用于检测人类感染(如巨细胞病毒和衣原体)的试剂和试剂产品,以及控制和校准材料。
⑥用于确定 HLA 组织群(DR、A、B)的试剂和试剂产品,以及控制和校准材料。
⑦用于测定肿瘤标志物(如 PSA)的试剂和试剂产品,以及控制和校准材料。
⑧用于确定 21 三体遗传风险特异性的试剂和试剂产品,以及控制和校准材料,还包括相关软件。
⑨用于自我诊断的产品(如测量血糖水平的产品),以及控制和校准材料。
⑩设备自测试:供非专业人员在家庭环境中进行自我测试的体外诊断医疗器械。
其他体外诊断医疗器械:未被归类在 LIST A 和 LIST B 中的其他体外诊断医疗器械。
4. 准入必要条件
MD和IVD都需要 ISO 13485。
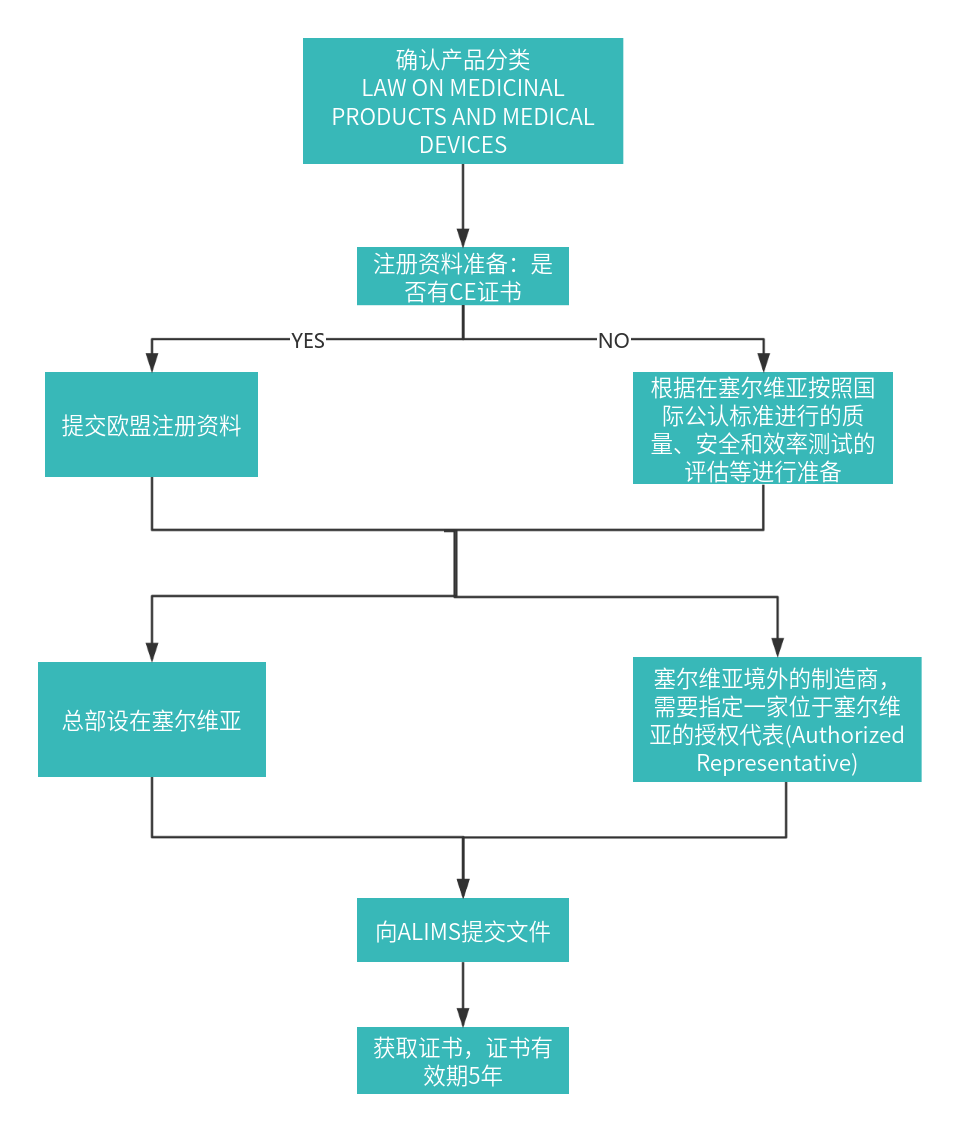
对于在塞尔维亚境外的制造商,需要指定一家位于塞尔维亚的授权代表(Authorized Representative)。授权代表负责与ALIMS沟通,并确保产品符合当地法规。由原产国监管机构或认可的公告机构颁发的产品注册证书或任何证明设备安全性和有效性。
注册要求:带有和不带有 CE 标志的医疗器械在塞尔维亚医疗器械注册的注册程序是不同的。
①带有 CE 标志的医疗器械是指由欧盟认可的机构控制的器械,意味着这些医疗器械符合欧盟关于医疗器械的指令。注册应根据符合欧盟医疗器械指令的相关证书和文件通过行政程序进行。
②没有CE标志的医疗器械注册应根据在塞尔维亚按照国际公认标准进行的质量、安全和效率测试的评估进行。
5. 注册语言
说明书、标签塞尔维亚语,其他注册资料可使用英语。
二、 注册流程,周期&官费
1. 注册流程图
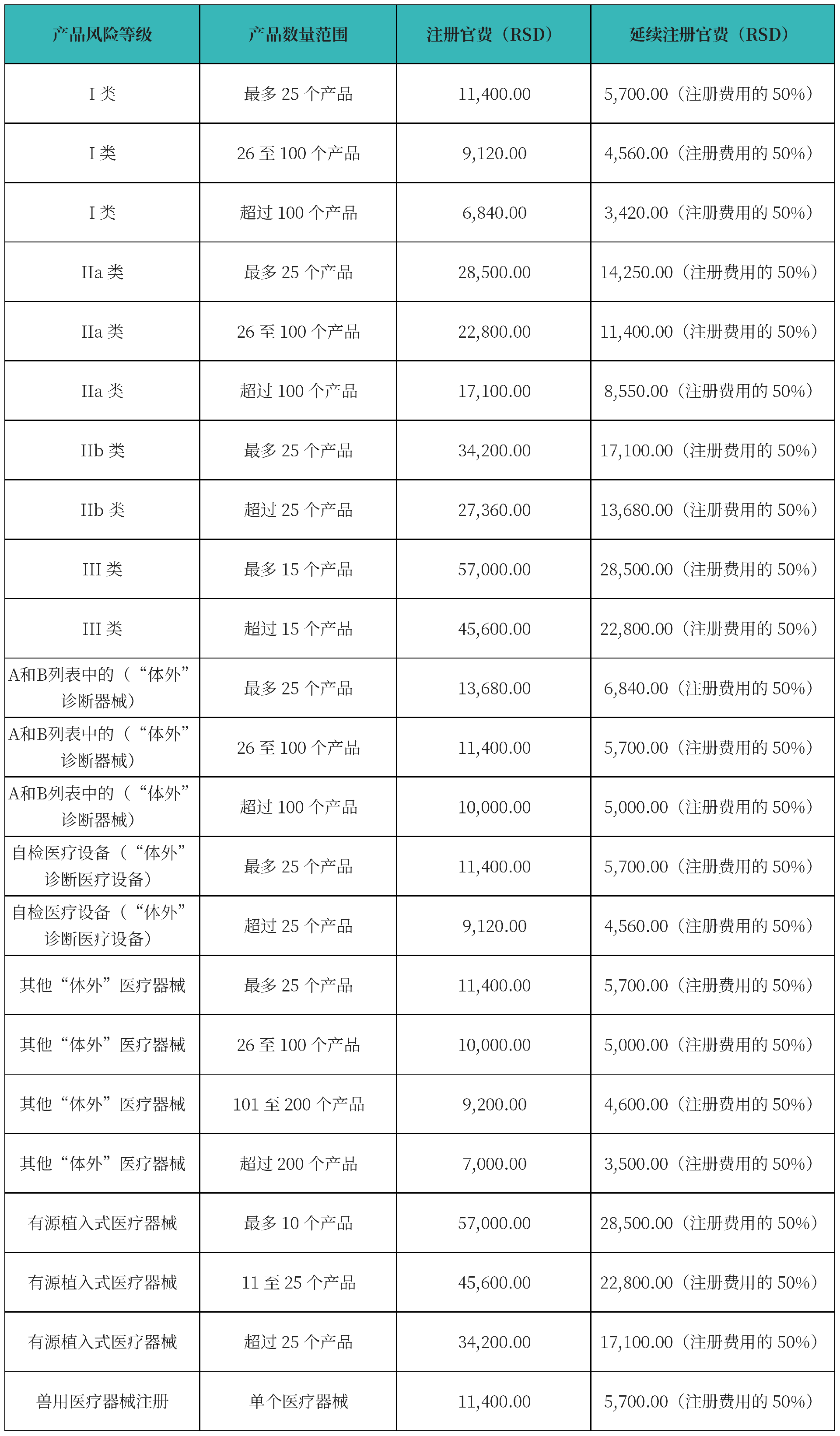
2. 注册周期及官费
注册周期为1-2个月:
ALIMS将会在申请方提交请求之日起的30天内,对符合基本要求的医疗器械进行登记。
如果医疗器械的注册申请不完整,ALIMS将会在收到申请之日起15日内通知申请方,并要求申请方在收到通知之日起30日内补充申请文件。
官费
三、 FAQ
Q:塞尔维亚医疗器械和 IVD 的监管政策是怎样的?
A:监管法规:塞尔维亚采纳了欧洲医疗器械指令,并依据相关法规对医疗器械进行管理。其法规要求涵盖了注册、生产、进口、销售、使用等环节。
特殊要求:非 CE 标记的器械可能需在当地实验室进行测试。
Q:医疗器械注册证书的有效期是多久?
A:在塞尔维亚,医疗器械注册证书的有效期一般为 5 年。但需注意的是,Ⅰ 类医疗器械(非无菌、非测量)和其他体外诊断试剂(IVD)的注册证书有效期为 5 年;而对于非 CE 标记的 Ⅰ 类医疗器械(无菌、测量),其注册证书有效期为 3 年。

