热烈庆祝!Wiselink印尼子公司WISELINK MEDICAL INDONESIA的正式成立,不仅为Wiselink在全球合规认证领域的征程中树立了又一重要里程碑,也标志着印尼成为Wiselink Group国际版图中重要的第13个站点,继澳洲、爱尔兰、美国、泰国、越南、日本、英国、新加坡、中国、中国香港、新西兰及俄罗斯之后,进一步扩展和深化了Wiselink的全球服务网络布局。
印尼,是东南亚最大的经济体,也是东南亚人口最多的国家,其医疗器械市场正迎来前所未有的发展机遇。随着印尼政府对医疗卫生领域投资的不断增加和民众健康意识的提升,高质量的医疗器械需求日益旺盛。
然而,医疗器械进入印尼市场需满足严格的监管要求,包括完成合规认证等关键步骤。Wiselink ID的成立,正是为了应对这一挑战,通过提供专业的注册指导与合规咨询服务,帮助医疗器械制造商快速、准确地理解并满足印尼市场的监管要求,确保产品合规上市,加速开拓印尼市场的步伐。
本篇文章,知汇将为您带来印尼医疗器械注册的详细知识介绍!
印尼卫生部Ministry of Health(MOH)是负责印尼医疗器械注册的监管机构,根据《2022年印尼卫生部令》第5号第5条,印尼卫生部履行以下职能:
制定、确定和执行公共卫生、疾病预防和控制、卫生服务、药品、医疗器械和卫生人员等领域的政策协调任务的执行,为卫生部内的所有组织机构提供指导和行政支持;
管理由卫生部负责的国家财产;
监督卫生部职责的执行情况;
对各地区执行卫生部事务的情况进行技术指导和监督;
制定并提供卫生发展政策建议;
为卫生部的所有部门提供实质性支持。
1. Government Regulation Number 72 of 1998 on Security to Pharmaceutical Preparation and Medical Devices (State Gazette of the Republic of Indonesia of 1998 Number 138, Supplement to the State Gazette of the Republic of Indonesia Number 3781)
2. Regulation of the Minister of Health Number 1189/MENKES/PER/VIII/2010 on Medical Device Production and Household Health Products (State Bulletin of the Republic of Indonesia of 2010 Number 399)
3. Regulation of the Minister of Health Number 1191/MENKES/PER/VIII/2010 on Medical Devices Distribution (State Bulletin of the Republic of Indonesia of 2010 Number 401)
医疗器械是指单独或组合使用的、用于以下一个或多个目的的仪器、器械、机器、工具和/或植入物、体外试剂和校准器、软件、材料或物质:
诊断、预防、监测、治疗或减轻疾病;
损伤的诊断、监测、治疗、缓解或恢复;
检查、替换、修改或支持解剖学或生理过程;
支持或维持生命;
控制受精;
医疗器械的消毒 ;
通过对人体标本进行体外测试,为医疗或诊断目的提供信息,其在人体内或对人体的主要作用不是实现药理学、免疫学和新陈代谢过程,但在实现其功能时可 能得到这些过程的帮助。
体外诊断产品是指任何试剂、试剂产品、校准物、控制材料、试剂盒、仪器、器械、设备或系统,不论是单独使用还是与其他试剂、试剂产品、校准物、控制材料、试剂盒、仪器、器械、设备或系统结合使用,产品所有者希望将其用于体外检查任何标本,包括取自人体的血液或供体组织,其唯一或主要目的是提供信息:
注意生理或病理状态或异常先天性 ;
确定任何血液或组织捐献者与潜在受血者的安全性和适宜性,或确定任何血液或组织捐献者与潜在受血者的安全性和适宜性;
监测治疗措施:包括标本容器。
利用电能或人体直接产生的能量或重力以外的其他能量进行操作的医疗器械;通过转换这些能量而工作的医疗器械。
用于在有源医疗器械和患者之间传递能量、物质或其他元素而不发生重大变化的医疗设备不属于有源医疗器械。
注:独立软件,只要符合医疗器械的定义,就被视为有源医疗器械。
无源医疗器械是指使用有源医疗器械所用能源以外的能源运行的医疗器械。
通过体内开口或体表全部或部分穿透人体的医疗器械。
全部或部分不通过体腔或体表穿透人体的医疗器械。
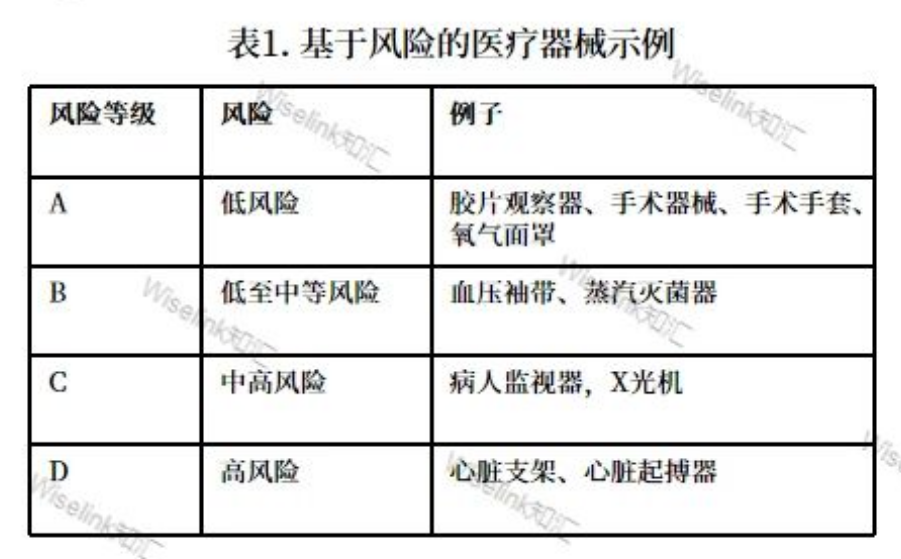
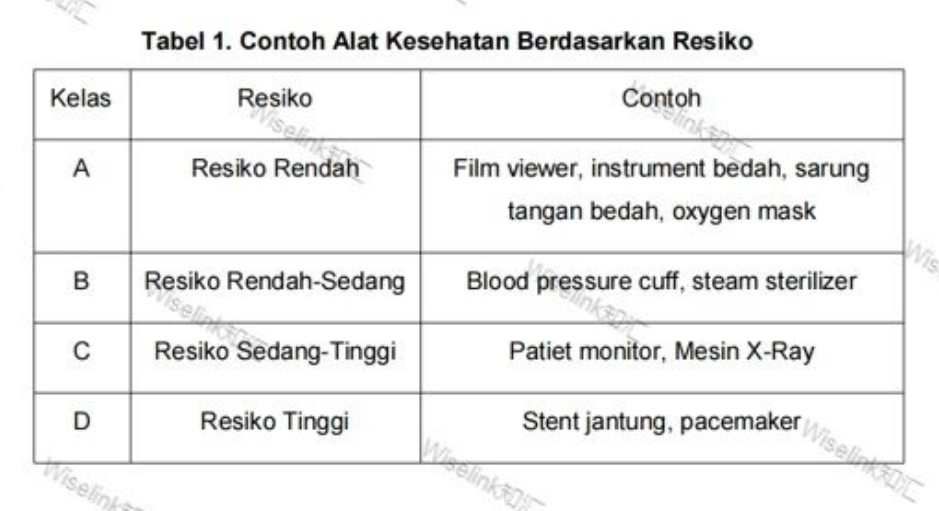
医疗设备是根据使用过程中的风险来分类的,根据这些风险,医疗器械分为以下四类(表 1)
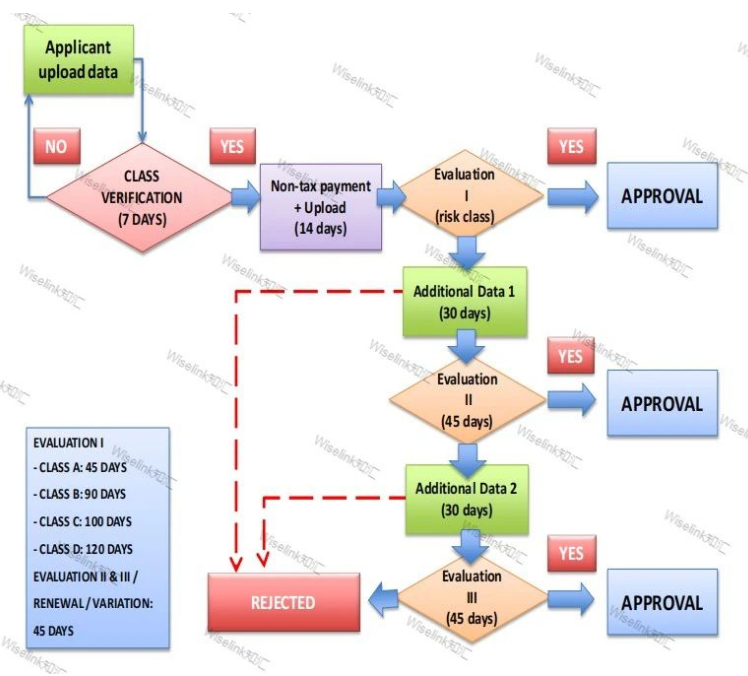
8.1 申请变更流通许可证应充分考虑以下事项
变更发行许可证的申请以电子方式通过电子注册系统选择变更菜单提出。通过电子注册系统,选择变更菜单
只要分销许可证的有效期仍然有效,就可以申请变更分销许可证
如果分销许可证上的数据发生变化,可申请修改分销许可证
流通许可证变更的有效期与旧的流通许可证一致
允许更改流通许可证数据的标准是不改变产品的质量和型号,即更改以下内容:
①尺寸,包括产品内容和/或尺寸的增减
②包装,包括:
增加或减少包装尺寸
增加或减少包装类型
包装形状设计的改变
包装材料的改变
③标记:
改变使用说明 (使用说明)和/或包装的语言变化
更改标志或符号,包括清真标志、质量管理体系、CE 和公司标志
更改产品有效期/失效日期(如果在标识中列出)
产品代码/类型的更改
改变储存温度
改进产品名称
更改标识设计(颜色、图像、文字和布局)、 颜色、图像、文字和布局)
④流通许可证的配件/附件:
附件
类型
产品代码
产品尺寸
⑤制造商/生产商授权代表的姓名和/或地址,包括:
制造商名称和/或法定地址变更
法人变更
因城市规划改变而变更工厂地址
只要制造商的地址未发生变化,即可更改工厂名称
如果 NPWP 和 NIB 没有变化,经销商名称的变更
分销商(经销商)迁至其他省份后地址的变更
⑥产品许可证上的文字
更改产品名称
变更分销商
制造商/生产商变更
制造商/生产商地点变更
产品型号变更
改变/增加原材料/配方,导致改变规格/功能
改变生产工艺(如消毒方法)
改变声称或说明
对制造商或生产商的整个产品的标识有影响,但不影响产品的安全、质量和实用性的变更,产品许可证的所有者必须向总干事提交一份通知。必须向局长提交通知。变更包括:
使用和/或包装说明中的语言变化。
更改标志或符号,包括清真标志、质量管理体系、CE和公司标志。
针对通知,总干事在收到通知后7(七)天内做出答复。
具有实体办公室的印尼当地公司
可以通过现场检查的仓库
具有医疗器械良好分销许可证或CDAKB证书
医疗器械营销授权书(经销商许可证)
具有药学、生物学、医学或化学专业本科学历的技术负责人
医疗器械注册服务
文件资料翻译服务
当地代理人服务
印尼海牙公证服务
自由销售证书服务
咨询辅导服务
CDAKB良好分销规范证书服务
技术文件编写服务
产品许可证持有人服务

