一、 日本医疗器械监管部门
1. 日本MHLW|PMDA

厚生劳动省MHLW(ministry of health,labor and welfare)负责确保医疗器械的质量和安全,并推动相关政策、法规的制定和实施,主要职责有:
① 制定医疗器械监管政策
② 注册批准的最终审查
③ 产品退市

日本药品和医疗器械局PMDA是负责产品审查和监管医疗器械上市的机构,是一个相对独立的行政机构,与WHLW合作,以确保医疗器械的安全和质量,PMDA协助WHLW医疗器械监管政策实施,其职责主要包括:
① 医疗器械审核审批
② QMS/GLP/GCP检查
③ 不良事件报告的收集和分析
2. 监管法规
Pharmaceutical and Medical Device Act,简称PMD act.
https://www.japaneselawtranslation.go.jp/ja/laws/view/3214
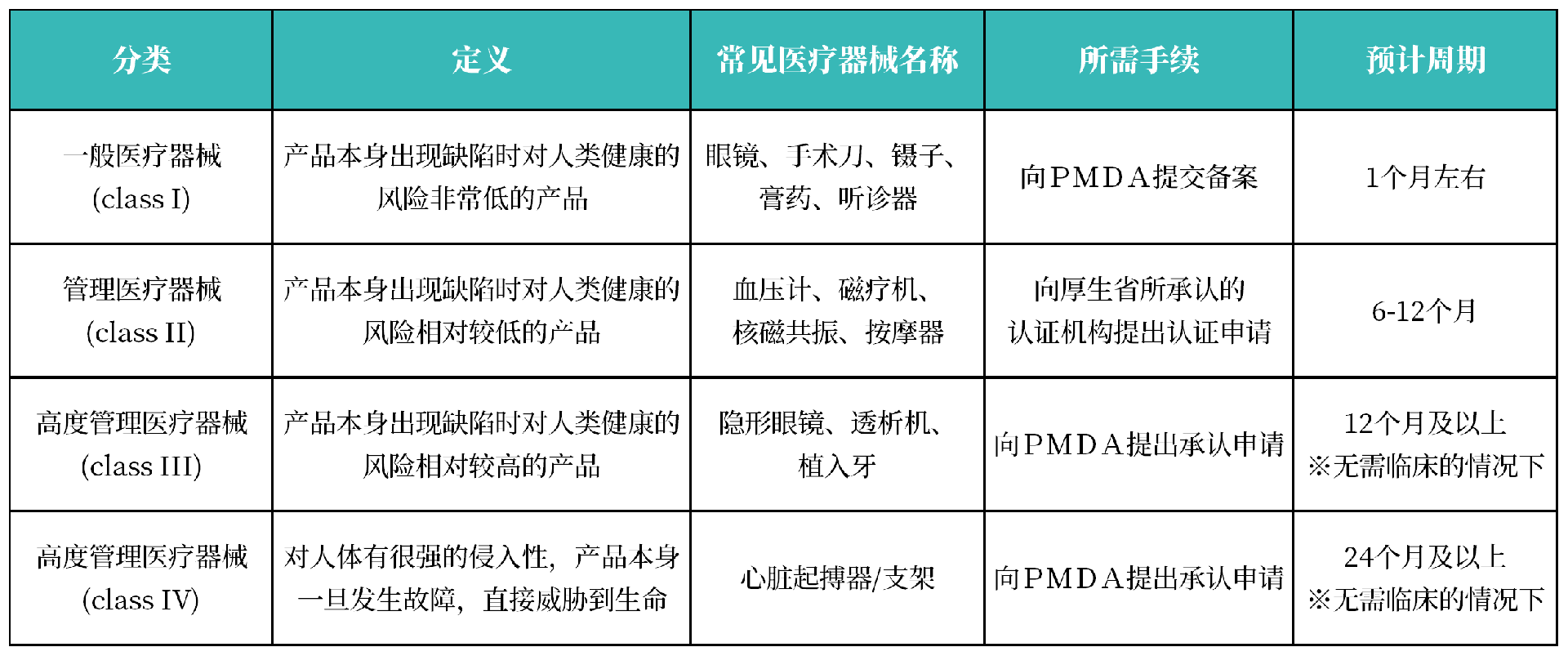
3. 风险等级分类
日本医疗器械分为I、II、III、IV 4个风险等级
4. 申请主体/证书持有人

5. 注册语言
日语
二、 注册流程
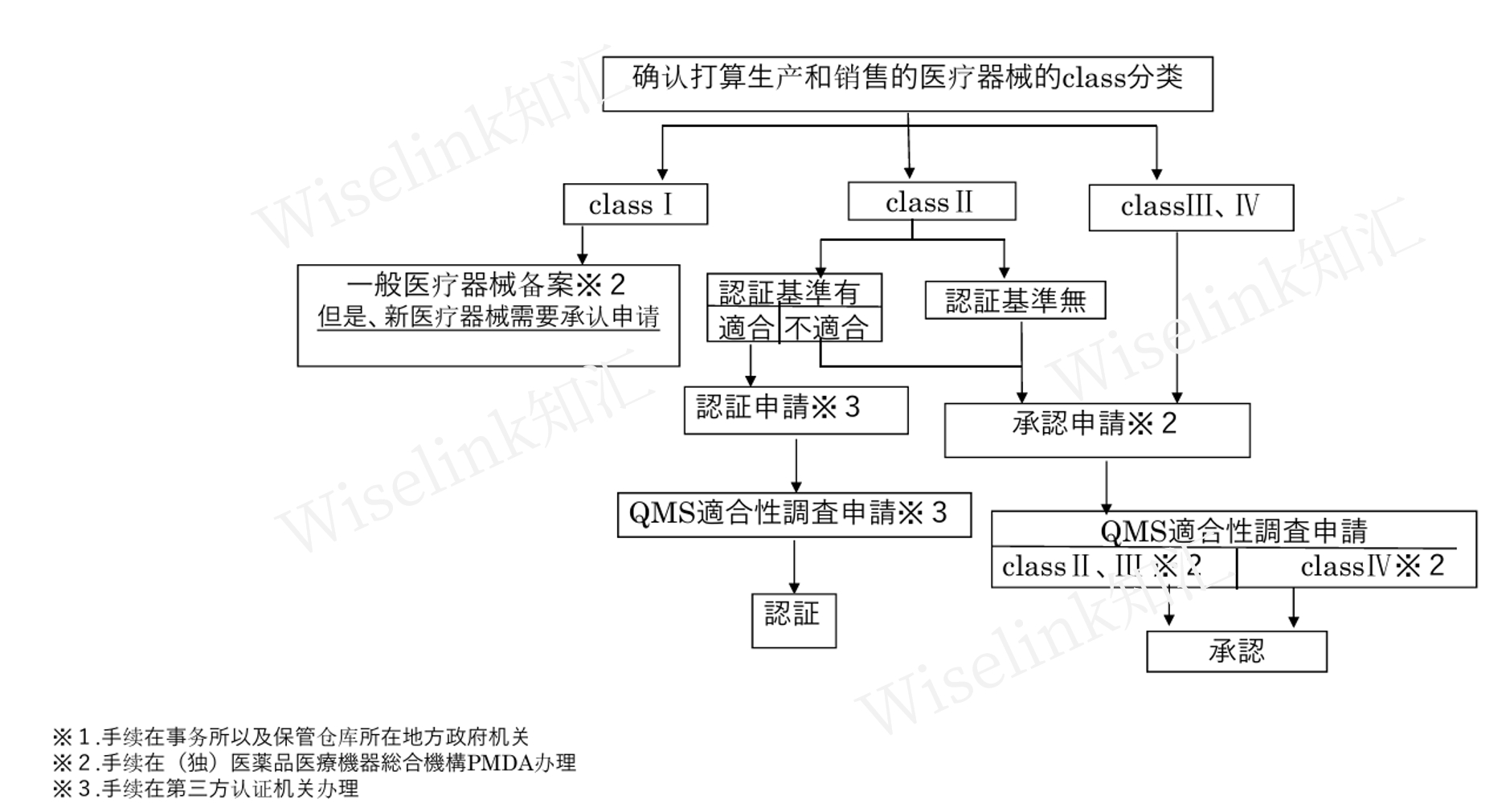
1. 注册流程

2. 医疗器械注册路径
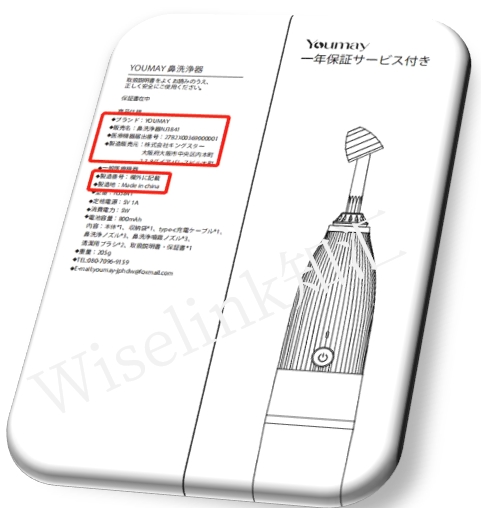
3. 标签|包装要求
PMD法案第63条规定了医疗器械直接容器或包装上需要说明的信息:
①营销授权持有人的姓名和地址
②名称
③制造编号或制造代码
④对于MHIW指定的医疗器械,内容物的重量、体积、数量等
⑤对于根据第41条第(3)款和第42条第(2)款规定规定了医疗器械的标准,这些标准中规定的事项应打印在直接容器或直接包装上
⑥MHLW指定的医疗器械的有效期
三、 FAQ
Q:医疗器械获得批准后需要注意哪些问题?
A:医疗器械注册不会过期,但注册人需要每5年更新一次QMS证书,注册人需要提前6个月启动续期程序。
Q:医疗器械进行日本注册需要QMS证书吗?
A:ClassI类不需要;ClassII类及以上需要,基本要求跟ISO 13485一样,除了直接提供ISO 13485证书和年审报告,还需要接受日本监管当局的QMS体系文件审查。
Q:在日本没有公司该如何进行医疗器械注册?
A:可以和日本的进口代理商合作,委托代理商协助完成产品认证手续,Wiselink JP株式会社可以作为中国制造商的日本DMAH,帮助中国制造商完成外国制造商登录和产品合规注册及清关进口服务。
Q:制造商没有ISO13485体系证书,可以用MDSAP证书吗?
A:可以。日本是MDSAP五国(澳大利亚、美国、 加拿大、巴西、日本)之一。
Q:如何确定医疗器械在日本是不是特定保守器械?
A:医疗器械在日本分为普通器械、特定保守器械、有基准、无基准器械等多个分类口径,如果要确认器械在日本的注册路径,可以联系Wiselink 知汇的商务经理进行询问。
四、证书模板

五、Wiselink Group日本子公司Wiselink JP
Wiselink Japan株式会社 是Wiselink Group的全资日本子公司,拥有日本医疗器械/IVD、化妆品的进口、经销资质,可以作为制造商在日本的当地代表,也可提供日本公司注册、申请经营资质、技术负责人、质量负责人等服务。




