一、 加拿大HC监管信息简介
1. 监管局及简介

加拿大卫生部 (HC, Health Canada) 是负责医疗器械安全、质量控制和警戒的监管机构。加拿大卫生部根据《食品与药品法》和《医疗器械条例》(SOR/98-282)对医疗器械进行监管。该监管程序确保了在加拿大销售的医疗器械是安全、有效和优质的。
2. 监管法规
自2019年1月1日起,由CMDCAS (加拿大医疗器械格评定体系)颁发的CAN/CSA-ISO 13485:2016:03和CAN/CSA-ISO 13485:2016:16证书不再被接受。因此,所有II类、III类和IV类设备的制造商必须转入医疗器械单一审核计划(MDSAP),以便在经认可的MDSAP审核组织(AO)成功审核后获得ISO 13485:2016证书(参考CAN/CSA-ISO 13485:2016:16, 见修正案SOR 2019-44, s.2)。
3. 医疗器械和IVD产品风险等级分类
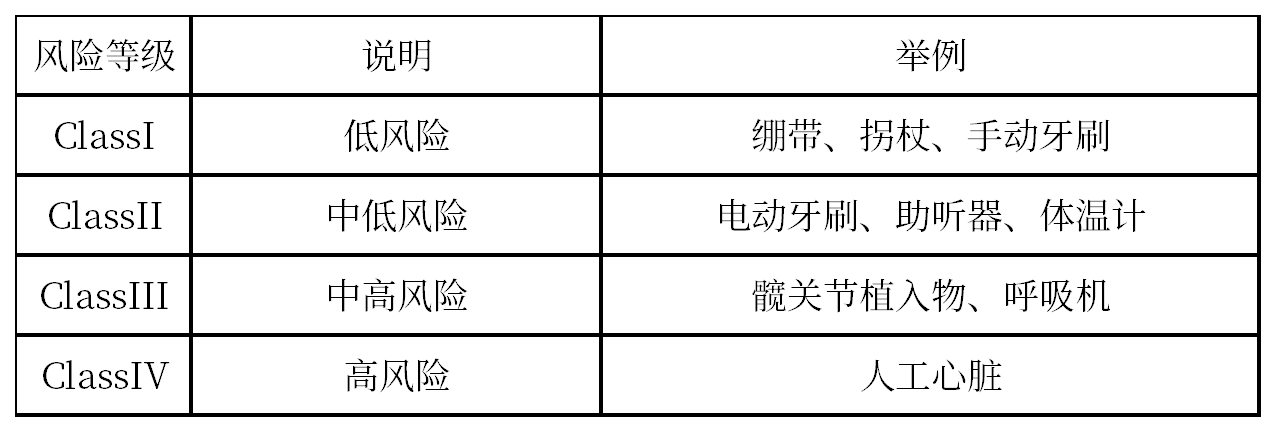
根据加拿大卫生部基于风险的分类体系,医疗器械可划分为下面几个类别: 根据加拿大医疗器械规定(CMDR)SOR/98-282第1部分附表1中的16条规定,医疗器械共划分为四种类别——I类、II类、III类和IV类。 根据CMDR第2部分附表1中的9条规定,IVD也被划归为从I类到IV类的不同类别。
分类举例:
4. 准入必要条件
Class I(一类器械):低风险器械,大多数Class I器械只需进行企业注册,取得MDEL和实施GMP(良好生产规范)即可进入市场。
Class II III IV(二三四类器械):中等风险器械。需要有MDL证书+MDSAP证书。
5. 注册语言 英语
二、 注册流程,周期&官费
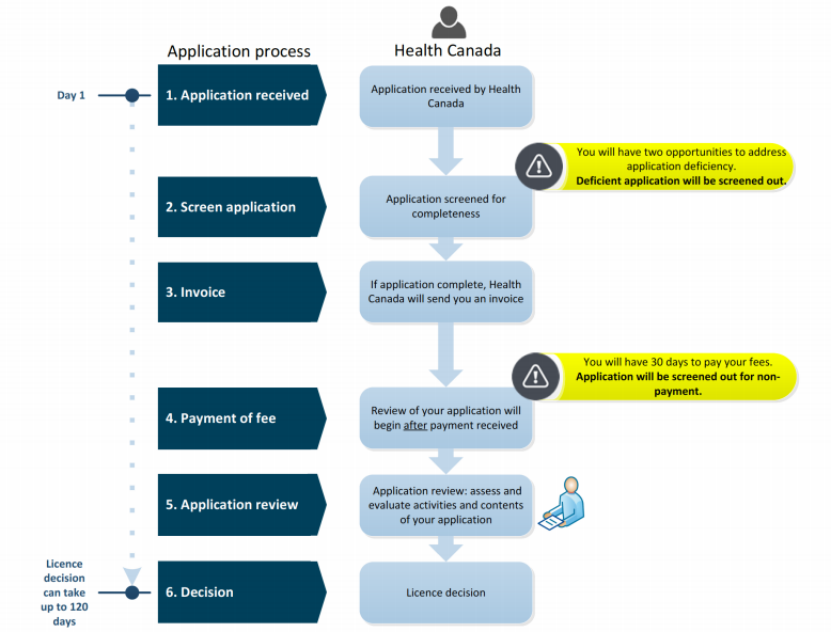
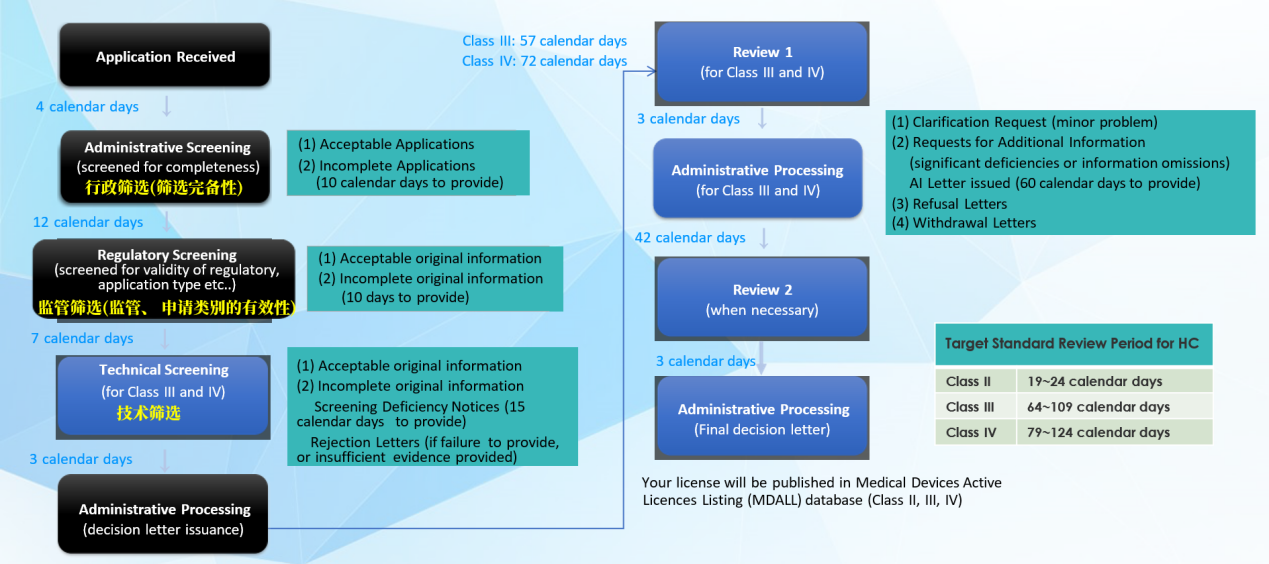
1. 注册流程图
MDEL申请流程:
MDL申请流程:
2. 注册周期及官费
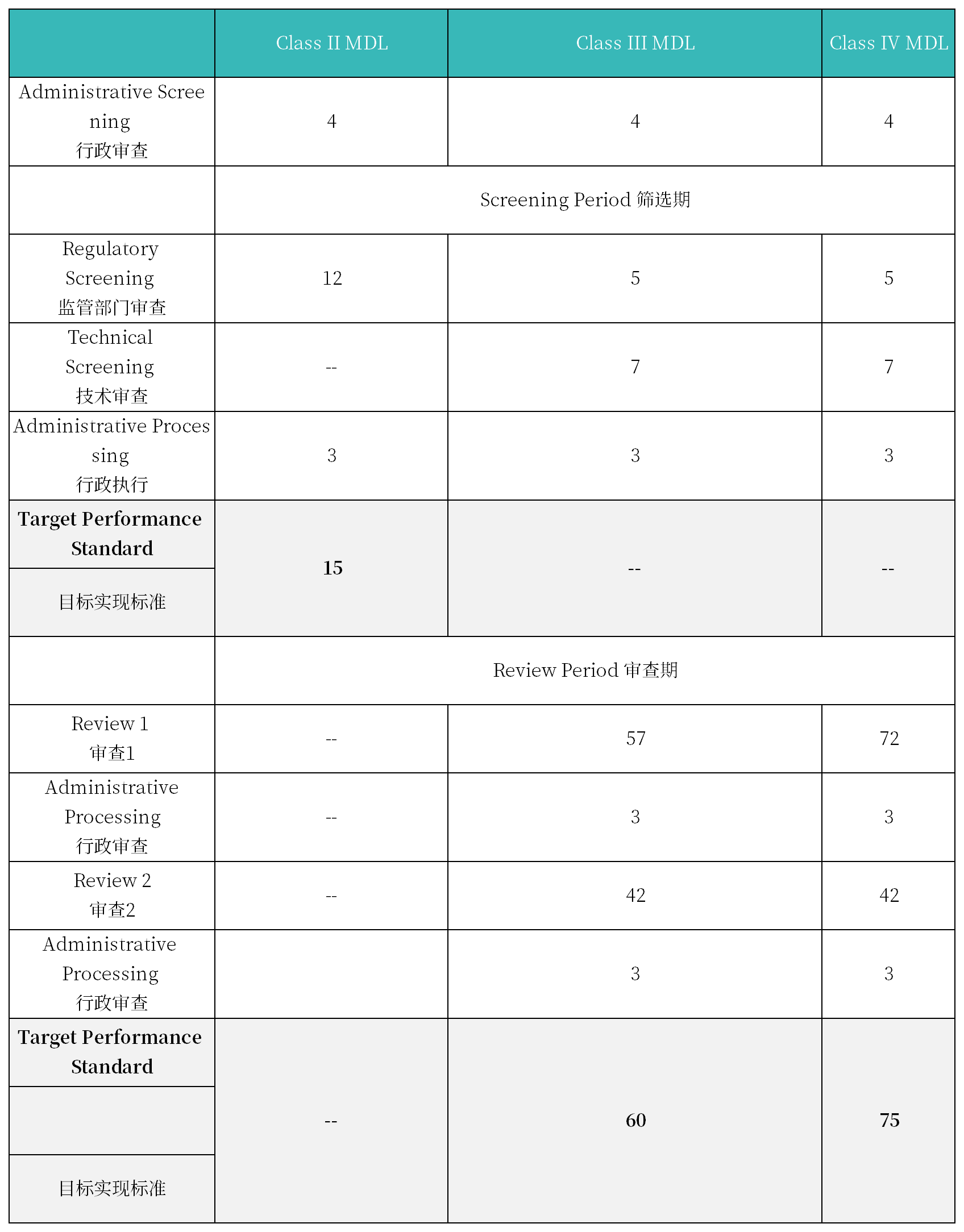
MDL申请官方费用:

MDEL申请官方费用:


三、 FAQ
Q:I类器械需要申请MDL吗?
A:不需要。
Q:听说加拿大认可美国FDA,只要做FDA就可以进入加拿大市场了?
A:FDA和HC发布了一个初步测试计划,共用一个系统eStar提交器械注册申请。
eStar是一个交互式的PDF表格模版,由 FDA研发。FDA要求所有510k申请从10.1 开始使用eStar系统提交。HC现在对eStar是试行阶段(已有10家公司参与测试)。
目前不存在FDA/HC互认机制。就算有eStar,也是分别审核。
Q:MDL证书有效期是多久?
A:MDL证书没有有效期,加拿大卫生部会在每年8月1 日至9月1 日之间以邮件形式将证书更新的申请材料发给制造商。每年11月1 日之前需要支付年费用于证书维护,否则证书将会被取消。
Q:加拿大对QMS体系的要求是怎样的?
A:HC 只接受由被称为加拿大医疗器械合格评定系统(CMDCAS)认可注册机构的特殊第三方审核组织颁发的质量体系证书。《医疗器械条例》并不要求医疗器械进口商或分销商拥有注册质量体系。
《医疗器械管理条例》要求 II、III 和 IV 类医疗器械必须根据 CAN/CSA ISO 13485:2003 进行生产(II 类)或设计和制造(III 和 IV 类)。
I 类医疗器械没有质量体系要求。

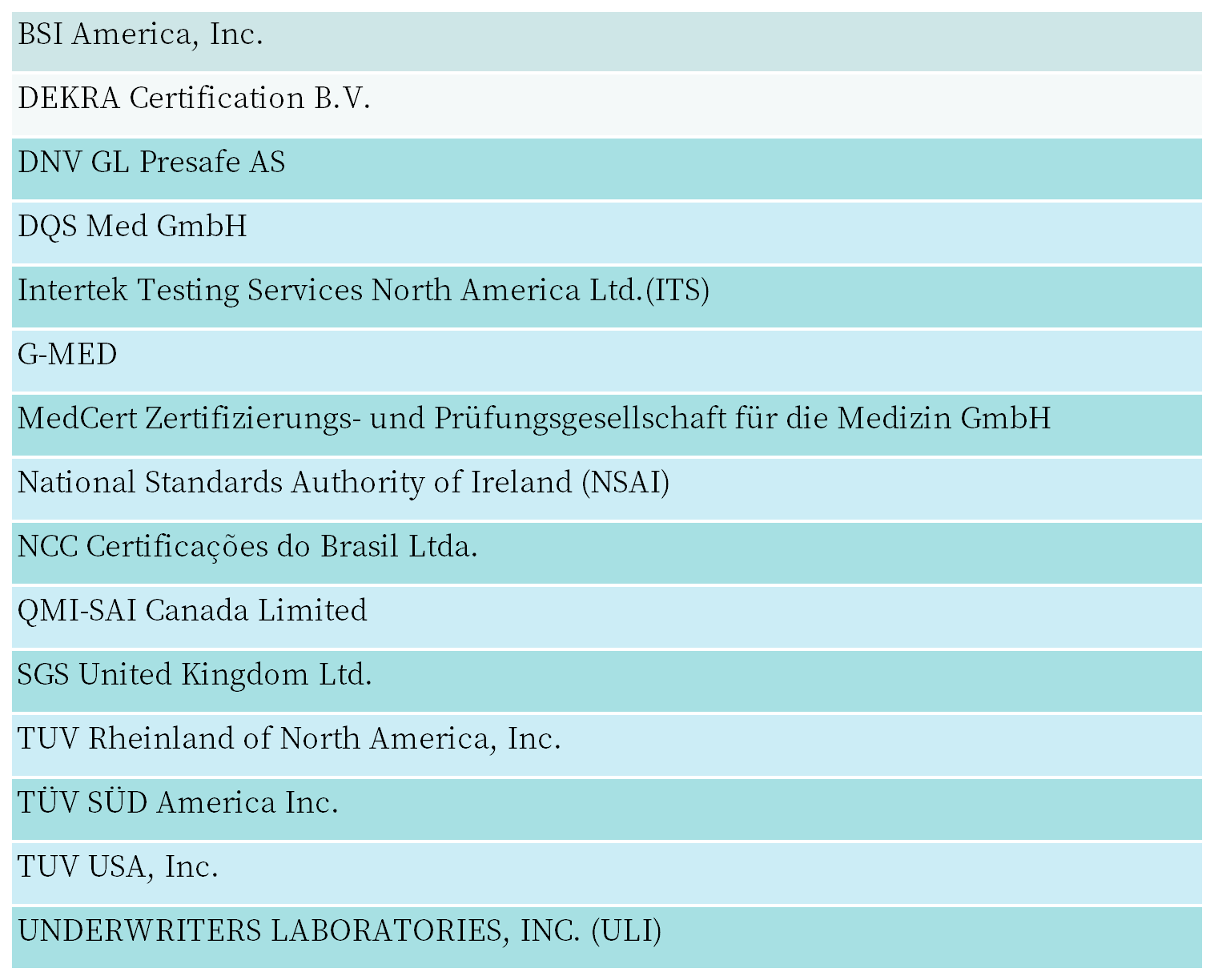
Q:加拿大卫生部认可的MDSAP发证机构有哪些?
A:Wiselink 知汇为您整理如下:
Q:加拿大境外的制造商申请了MDEL,加拿大境内的进口商还需要申请MDEL吗?
A:必须要。加拿大对进口商的定义为:医疗器械制造商以外且位于加拿大境内的人,负责将医疗器械带到加拿大出售。加拿大境内的进口商在进口医疗器械时必须有申请MDEL许可证。
Q:中国制造商可以作为加拿大进口商吗?
A:不可以。加拿大对进口商的定义为:医疗器械制造商以外且位于加拿大境内的人。
Q:MDEL注册好后,以后每年还要交年费是吗?
A:是的。在加拿大获得MDEL许可证后,每年需要支付年费以保持许可证的有效性。
Q:加拿大注册需要像欧代美代一样的加代吗?
A:不需要。加拿大没有类似于欧盟的授权代表(Authorized Representative)的制度。
Q:小企业资质的MDL费用减免中的小企业条件是什么?
A:小企业是指少于100名员工,或者年总收入在15.5万RMB---2584万RMB之间的任何企业(包括其所有附属公司)。符合此定义的制造商有资格获得:所有MDL申请折扣50%,第一次提出申请,一次性免除费用。即使制造商在HC做出最终决定之前撤回申请,或者没有收到HC的决定,该申请也被认为是首次提交的申请,HC将不会审查未来的免费申请。

